
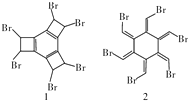
| A. | 有机物1和2互为同分异构体,分子式为C12H6Br6 | |
| B. | 有机物1和2在氢氧化钠的乙醇溶液中均可发生消去反应 | |
| C. | 有机物1和2中所有原子均共平面 | |
| D. | 有机物2能使酸性高锰酸钾溶液褪色,而有机物1不能使酸性高锰酸钾溶液褪色 |
分析 有机化合物1和2分子式都为C12H6Br6,但结构不同,1含有苯环,2含有碳碳双键,结合苯、乙烯的结构和性质解答该题.
解答 解:A.有机物1和2的结构不同,分子式相同都为C12H6Br6,是同分异构体,故A正确;
B.卤代烃发生消去反应的条件:与卤素原子所连的碳相邻的碳要有氢原子,有机物1满足条件,而有机物2与卤素原子所连的碳相邻的碳没有氢原子,不满足条件,故B错误;
C.化合物1具有饱和碳原子,具有甲烷的结构特点,则不可能公平面,故C错误;
D.因碳碳双键能使溴水、酸性高锰酸钾溶液褪色,有机物1中含有苯环,但苯环中没有碳碳双键,而是一种介于碳碳双键和碳碳单键之间独特的键,酸性高锰酸钾溶液不褪色,但如果与苯环相连的碳原子上有氢原子,根据苯的同系物的性质,有机物1能使酸性高锰酸钾溶液褪色,有机物2含有6个碳碳双键,能使酸性高锰酸钾溶液褪色,故D错误;
故选A.
点评 本题考查有机物的结构和性质,为高考常见题型和高频考点,侧重于学生的分析能力的考查,本题着重于有机物的结构的考查,注意把握结构特点以及官能团的性质,难度不大.


科目:高中化学 来源: 题型:解答题

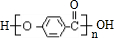
 .
.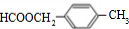 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 实验室常用点滴板来完成部分实验,这样可以节约药品的用量,又便于观察实验现象.图中所示的实验描述的现象正确的是( )
实验室常用点滴板来完成部分实验,这样可以节约药品的用量,又便于观察实验现象.图中所示的实验描述的现象正确的是( )| A. | ①②③⑤ | B. | ①②⑥ | C. | ③⑤⑥ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2molAl与足量NaOH溶液反应,生成的H2分子数为0.3NA | |
| B. | 常温下,1LpH=1的盐酸溶液,由水电离的H+离子数目为0.1NA | |
| C. | 标准状况下,0.1mol氯仿的体积为2.24L | |
| D. | 11P4+60CuSO4+96H2O=20Cu3P+24H3SO4+60H2SO4反应中,6molCuSO4能氧化白磷的分子数为1.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 已知 | 解释与结论 |
| A | 活泼金属Al、不活泼金属Cu和浓硝酸可以形成原电池 | Al作正极,Cu作负极 |
| B | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) 该反应在常温下能自发进行 | 该反应的△H<0 |
| C | 常温下,Ksp(AgCl)=1.8×10-10、 Ksp(AgBr)=5.4×10-13 | 向BaCl2溶液中加入AgNO3和KBr,当AgCl、AgBr两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=3×10-3 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,振荡,溶液变为黄色 | 氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
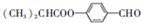 ,G的一种合成路线如下:
,G的一种合成路线如下: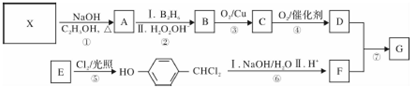
 ;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基.请回答下列问题:
;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基.请回答下列问题: .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO的结构式:H-Cl-O | |
| B. | NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32- | |
| C. | 羟基的电子式: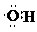 | |
| D. | 异丙醇的结构简式:CH3CH2CH2OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com