
【题目】溴、碘主要存在于海水中,有“海洋元素”的美称。海水中的碘主要富集在海带中,我国海带产量居世界第一位,除供食用外,大量用于制碘。提取碘的途径如下图所示,下列有关叙述正确的是
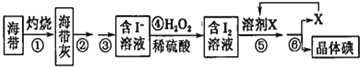
A. 此装置进行操作①
此装置进行操作①
B.②③操作中所用到的玻璃仪器有:玻璃棒、烧杯、分液漏斗
C.④中当1molH2O2氧化I-时,转移电子数为2NA
D.溶剂X可选用酒精或苯
【答案】C
【解析】
由流程可知,海带灼烧后,溶解、过滤得到含碘离子的溶液,加过氧化氢发生H2O2+2H++2I-═I2+2H2O,得到含碘的溶液,溶剂X为苯或四氯化碳等,X作萃取剂,得到含碘的有机溶液,最后蒸馏分离X与晶体碘,以此来解答。
A.灼烧选坩埚,不能选蒸发装置,故A错误;
B.溶解、过滤需要玻璃棒、烧杯、漏斗,不用分液漏斗,故B错误;
C.由H2O2+2H++2I═I2+2H2O可知,④中当1molH2O2氧化I时生成1mol碘单质,碘元素由-1价变为0价,转移2mol电子,转移电子数为2NA,故C正确;
D.X不能为酒精,酒精与水互溶,无法分液萃取提纯碘,故D错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】2017年冬季,我国北方大部分地区出现严重雾霾天气,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等。城市雾霾中还含有铜等重金属元素。
(1)N元素原子核外电子云的形状有___________种;基态铜原子的价电子排布式为___________,金属铜的晶体中,铜原子的堆积方式为___________。
(2)N和O中第一电离能较小的元素是___________;SO42-的空间构型___________。
(3)NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为___________。
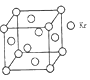
(4)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,晶胞边长为540pm,则该晶体的密度___________g/cm3(只列式不计算)(1pm=10-10cm)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫的催化氧化原理为2SO2(g)+O2(g)![]() 2SO3(g)。在一定压强下,反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示。下列说法不正确的是
2SO3(g)。在一定压强下,反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示。下列说法不正确的是
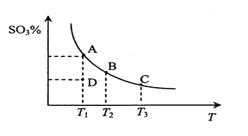
A. 反应2SO2(g)+O2(g)![]() 2SO3(g)的△H<0
2SO3(g)的△H<0
B. 在D点时v(正)<v(逆)
C. 若B、C点的平衡常数分别为KB、KC,则KB>KC
D. 恒温恒压下向平衡体系中通入氦气,平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铜-锌-稀硫酸构成的原电池中,当导线中有1mol电子通过时,下列说法正确的是
①锌片溶解了32.5g ②溶液中![]() 向铜片电极移动 ③正极上发生氧化反应产生了H2 ④铜片上逸出0.5molH2
向铜片电极移动 ③正极上发生氧化反应产生了H2 ④铜片上逸出0.5molH2
A.①③B.①④C.②③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是常用的氧化剂。某化学小组在实验室以软锰矿(主要成分是MnO2)为原料制备KMnO4,下图是实验室制备高锰酸钾的操作流程。

已知:
温度 | 溶解度/g | ||
K2CO3 | KHCO3 | KMnO4 | |
20℃ | 111 | 33.7 | 6.38 |
请回答:
(1) 反应①的化学方程式为______________________________________,加热软锰矿、KClO3和KOH固体,除三脚架、玻璃棒、泥三角和铁坩埚外,还用到的仪器有___,不采用瓷坩埚而选用铁坩埚的理由是______________
(2) 反应②中氧化产物与还原产物的物质的量之比为___________________;上述流程中可以循环利用的物质是__________________________。
(3) 实验时,从滤液中得到KMnO4晶体的实验操作a为___________________,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大。A能分别与B、C、D三种元素形成电子数相同的分子,且B的最外层电子数是次外层电子数的2倍。E的阳离子、D的阴离子均与氖原子的电子层结构相同,且E的单质与D的单质反应能生成E2D和E2D2两种化合物。F所在主族序数与所在周期序数之差为4。(答题时,请用具体的化学用语表示)
(1)元素B在周期表中的位置__________周期________族;C元素的原子结构示意图_________________。
(2)写出由E、F两种元素形成的离子化合物的电子式________________,C2A4的结构式为:_______________,用电子式表示E2D的形成过程:_____________________。
(3)C、D、E形成的简单离子的半径由大到小的顺序为:_____________________。(用离子符号表示)
(4)E的最高价氧化物对应的水化物与F的最高价氧化物对应的水化物之间发生的化学反应方程式为:______________________________________________________________。
(5)向KI溶液中通入适量的F单质后,再滴加一定量的CCl4,振荡静置后的现象为_____________________________________,继续通入F单质并充分振荡,混合溶液逐渐褪为无色,若1mol还原剂转移10NA电子,上述反应的化学方程式为:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共2.88g,经如下处理:

下列说法正确的是
A.滤液A中的阳离子为Fe2+、Fe3+、H+B.V=224
C.样品中CuO的质量为2.0gD.样品中铁元素的质量为0.56g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数,下列叙述错误的是( )
A. 18g H2O中含的质子数为10NA
B. 1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
C. 46g NO2和N2O4混合气体中含有原子总数为3NA
D. 12g金刚石含有的共价键数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尼龙材料是一种性能优良的工程塑料,目前广泛应用于汽车领域,具有优异的力学性能。以A(C6H10)原料通过氧化反应制备G,再通过缩聚反应合成尼龙,合成路线如下:

回答下列问题:
(1)A的化学名称为_________________;
(2)B到C的反应类型为_______________;
(3)D中含有的官能团名称是____________;
(4)E的分子式为_____________;
(5)由G合成尼龙的化学方程式为________________________________;
(6)写出一种与C互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,峰面积之比为3:1)_____________。
(7)1,4-二溴环己烯(![]() )是多数有机合成一种重要的中间体,设计由B为起始原料制备1,4-二溴环己烯的合成路线____________________。
)是多数有机合成一种重要的中间体,设计由B为起始原料制备1,4-二溴环己烯的合成路线____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com