
【题目】两种金属接触时,接触部位会发生“电偶腐蚀”。金属铁和铜在自来水和海水中,相同时间发生的腐蚀情况如图。下列有关说法正确的是( )
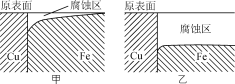
A.甲图中的介质为海水
B.腐蚀过程中电能转化为化学能
C.铁电极反应式为Fe-3e-=Fe3+
D.若在金属表面涂油漆,可以减弱铁的腐蚀
科目:高中化学 来源: 题型:
【题目】电解Na2CO3溶液可制取NaHCO3溶液和NaOH溶液,原理如下图所示。下列说法不正确的是

A.b极为阴极,产生的气体A为H2
B.溶液中的Na+通过交换膜由b极室到a极室
C.B可以使用稀NaOH溶液,其效果优于纯水
D.a极电极反应为4CO32-+2H2O-4e-=4HCO3-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:Ksp(BaCO3)=5.1×10–9;Ksp(BaSO4)=1.1×10–10。下列推断正确的是( )
A.可以用0.36 mol·L–1的Na2SO4溶液给钡离子中毒患者洗胃
B.抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替
C.若误饮c(Ba2+)=1.0×10–5 mol·L–1的溶液时,会引起钡离子中毒
D.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入2L的恒容密闭容器中,在一定条件下发生反应PCl3(g)+Cl2(g)![]() PCl5(g),△H<0并于10min时达到平衡。有关数据如下:下列判断正确的是
PCl5(g),△H<0并于10min时达到平衡。有关数据如下:下列判断正确的是
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度/(molL-1) | 2.0 | 1.0 | 0 |
平衡浓度/(molL-1) | c1 | c2 | 0.4 |
A.10min内,v(Cl2)=0.02mol/(Lmin)
B.升高温度,反应的平衡常数增大
C.反应达到平衡时容器内的压强与初始时容器的压强之比为1:2
D.平衡后移走2.0molPCl3和1.0molCl2,相同条件下再达平衡时,c(PCl5)<0.2molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
(1)将一定量的FeSO4·7H2O溶于稀硫酸,在约70 ℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。H2O2氧化Fe2+的离子方程式为________;水解聚合反应会导致溶液的pH________。
(2)测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000 g,置于250 mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×102 mol·L1 K2Cr2O7溶液滴定至终点(滴定过程中![]() 与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00 mL。
与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00 mL。
①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将________(填“偏大”或“偏小”或“无影响”)。
②计算该样品中铁的质量分数(写出计算过程)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连
B.将1 mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2×6.02×1023
C.常温下,C(s)+H2O(g)![]() CO(g)+H2(g)不能自发进行,则该反应的ΔH>0
CO(g)+H2(g)不能自发进行,则该反应的ΔH>0
D.保持温度不变,向稀氨水中缓慢通入CO2,溶液中![]() 的值增大
的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不属于盐类水解应用的是( )
A.明矾、氯化铁晶体常用于净水
B.实验室通常在HCl气氛中加热MgCl2·6H2O制MgCl2
C.实验室配制FeCl3溶液时加入少量稀盐酸
D.实验室制氢气时加入CuSO4可加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果,下列图像描述正确的是

A. 图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B. 图②表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(g)的影响,且甲的压强大
3C(g)+D(g)的影响,且甲的压强大
C. 图③表示向Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液体积的关系
D. 图④表示在2 L的密闭容器中发生合成氨反应时N2的物质的量随时间的变化曲线,0~10 min内该反应的平均速率v(H2)=0.045 mol·L-1·min-1,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是
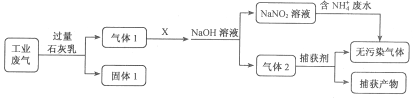
A. 固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B. X可以是空气,且需过量
C. 捕获剂所捕获的气体主要是CO
D. 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-==N2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com