
| A. | 1 mol OH-中含有的电子数目为9 NA | |
| B. | 标准状况下,22.4 L乙醇含有的分子数目为 NA | |
| C. | 1 L 0.1 mol/L NH4Cl溶液中,NH4+的数目为0.1 NA | |
| D. | 0.3 mol NO2溶于水生成HNO3,转移的电子数目为0.2 NA |
分析 A.氢氧根离子是10个电子的阴离子;
B.标况下,乙醇为液态;
C.铵根易发生水解;
D.该反应中N元素的化合价由+4价变为+5价和+2价,所以二氧化氮既是氧化剂又是还原剂,硝酸是氧化产物,NO是还原产物,根据二氧化氮和转移电子之间的关系式计算转移电子的物质的量.
解答 解:A.氢氧根离子是10个电子的阴离子,1mol OH-含有电子数目为10NA,故A错误;
B.标况下,乙醇为液态,故其物质的量不能根据气体摩尔体积来计算,故B错误;
C.铵根易发生水解,NH4+的数目小于0.1 NA,故C错误;
D.在反应中若有3molNO2反应,即生成1molNO时,则有2molNO2被还原,所以有2mol电子发生转移,0.3 mol NO2溶于水生成HNO3,转移的电子数目为0.2 NA,故D正确.
故选D.
点评 本题考查阿伏加德罗常数的相关计算,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | H2SO4具有氧化性 | B. | H2SO3具有还原性和氧化性 | ||
| C. | H2S具有氧化性 | D. | S具有还原性和氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2 与Y2 | B. | XY 与X2 | C. | X2 与YX | D. | YX 与Y2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
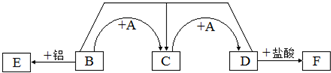
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 两条曲线上任意点均有c(H+)×c (OH-)=Kw | |
| B. | T<25 | |
| C. | b点和c点pH均为6,溶液呈酸性 | |
| D. | 只采用升温的方式,可由a点变成d点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积/mL | 标准碘溶液体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 平均值 | ||
| 1 | 25.00 | 0.00 | 14.97 | ① |
| 2 | 25.00 | 0.10 | 15.13 | |
| 3 | 25.00 | 0.22 | 14.93 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com