
| A. | 将等物质的量的KHC2O4和H2C2O4溶于水配成溶液:2c(K+)═c(HC2O4-)+c(H2C2O4) | |
| B. | 0.1 mol•L-1NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH${\;}_{4}^{+}$)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/L的CH3COOH溶液加水稀释,$\frac{c({H}^{+})}{c(C{H}_{3}CO{O}^{-})}$的比值将增大 | |
| D. | 0.1mol/LCH3COONa溶液与0.15mol/LHCl等体积混合:c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-) |
分析 A.根据混合液中的物料守恒判断;
B.混合液的pH大于7,说明一水合氨的电离程度大于铵根离子的水解程度,则c(NH4+)>c(NH3•H2O),结合物料守恒可知c(NH4+)>c(Cl-)>c(NH3•H2O);
C.稀释过程中醋酸的电离程度增大,则氢离子的物质的量增大、醋酸的物质的量减小,结合在同一溶液中判断该比值;
D.0.1mol/LCH3COONa溶液与0.15mol/LHCl等体积混合,反应后溶质为0.05mol/L的醋酸、0.025mol/L的HCl、0.05mol/L的NaCl,据此判断各离子浓度大小.
解答 解:A.将等物质的量的KHC2O4和H2C2O4溶于水配成溶液,根据物料守恒可得:2c(K+)═c(HC2O4-)+c(H2C2O4)+c(C2O42-),故A错误;
B.0.1 mol•L-1NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7),说明一水合氨的电离程度大于铵根离子的水解程度,则c(NH4+)>c(NH3•H2O),结合物料守恒可知c(NH4+)>c(Cl-)>c(NH3•H2O),故B错误;
C.0.1mol/L的CH3COOH溶液加水稀释,醋酸的电离程度增大,则氢离子的物质的量增大、醋酸的物质的量减小,由于在同一溶液中,则$\frac{c({H}^{+})}{c(C{H}_{3}CO{O}^{-})}$的比值将增大,故C正确;
D.将0.1mol/LCH3COONa溶液与0.15mol/LHCl等体积混合后,溶质为0.05mol/L的醋酸、0.025mol/L的HCl、0.05mol/L的NaCl,离子浓度最大的为c(Cl-),其次为c(Na+),则正确的离子浓度大小为:c(Cl-)>c(Na+)>c(H+)>c(CH3COO-)>c(OH-),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义,试题培养了学生的分析能力及灵活应用能力.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
对于可逆反应N2(g)+3H2(g) 2NH3(g) △H<0,下列研究目的和示意图相符的是
2NH3(g) △H<0,下列研究目的和示意图相符的是
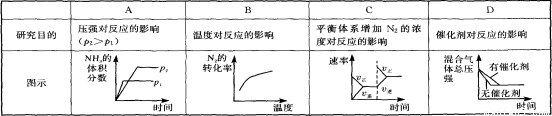
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 原物质 | 所含杂质 | 除杂试剂 | 主要操作方法 | |
| A | HNO3溶液 | H2SO4 | BaCl2溶液 | 过滤 |
| B | CO2 | SO2 | 酸性KMnO4溶液、浓硫酸 | 洗气、干燥 |
| C | SiO2 | Al2O3 | 稀盐酸 | 过滤 |
| D | C2H5OH | CH3COOH | CaO | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:

已知碳的燃烧热△H1=akJ·mol—1
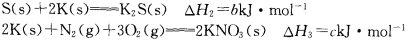
则x为
A.a+b-c B.c+3a-b C.3a+b-c D.c+a-b
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com