
下列各项操作中不发生先沉淀后溶解现象的是( )
①向饱和碳酸钠溶液中加入过量的氯化钙溶液
②向Fe(OH)3胶体中逐滴滴加入过量H2SO4
③向Ba(NO3)2溶液中加入过量的稀硫酸
④向石灰水中通入过量CO2.
|
| A. | ①② | B. | ②⑤ | C. | ①③ | D. | ③⑤ |
考点:
钠的重要化合物;胶体的重要性质.
专题:
元素及其化合物.
分析:
①氯化钙和碳酸钠反应生成碳酸钙沉淀;
②根据胶体的性质判断,加入稀硫酸产生聚沉现象,H2SO4与Fe(OH)3反应,所以出现先沉淀后溶解现象;
③向Ba(NO3)2溶液中通入过量稀硫酸生成硫酸钡沉淀;
④根据石灰水和CO2反应,生成CaCO3沉淀,继续通入CO2,会与CaCO3反应生成可溶的Ca(HCO3)2.
解答:
解:①向饱和碳酸钠溶液中加入过量的氯化钙溶液,碳酸钠和氯化钙反应只生成碳酸钙沉淀,碳酸钙不能溶解,所以不出现“先产生沉淀,然后沉淀又溶解”现象,故①不符合;
②因Fe(OH)3胶体加入稀硫酸产生聚沉现象,H2SO4与Fe(OH)3反应,沉淀又溶解,所以出现先沉淀后溶解现象,故②符合;
③向Ba(NO3)2溶液中通入过量稀硫酸生成硫酸钡沉淀,硫酸钡不能溶解,故③不符合;
④石灰水和CO2反应,生成CaCO3沉淀,继续通入CO2,会与CaCO3反应生成可溶的Ca(HCO3)2,沉淀又溶解,所以出现先沉淀后溶解现象,故④符合;
故选C.
点评:
本题主要考查的是物质的性质,根据物质的性质结合方程式分析本题即可,需要注意的是胶体的性质.


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
高温下,某反应达到平衡,平衡常数K=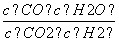 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2O
 CO2+H2
CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分离或提纯物质的方法正确的是( )
|
| A. | 用蒸馏的方法制取蒸馏水 |
|
| B. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |
|
| C. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
|
| D. | 用加热、蒸发的方法可以除去CaCl2、MgCl2等杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列无色离子一定能大量共存的是( )
|
| A. | 0.1mol•L﹣1MgCl2溶液:K+、H+、S2﹣、Cl﹣ |
|
| B. | 0.1mol•L﹣1的Na2CO3溶液:K+、Ba2+、NO3﹣、Cl﹣ |
|
| C. | 0.1mol•L﹣1的NaOH溶液:K+、Na+、SO42﹣、CO32﹣ |
|
| D. | 1.0mol•L﹣1的KNO3溶液:H+、Fe2+、Cl﹣、SO42﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
R2O8n﹣离子在一定条件下可以把Mn2﹣氧化为MnO4,若反应后R2O8n﹣离子变为RO42离子,知反应中氧化剂与还原剂的离子数之比为5:2,则R2O8n﹣离子中R元素的化合价以及n值分别为( )
|
| A. | +7、2 | B. | +6、2 | C. | +5、1 | D. | +4、1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中符合图象的是( )

A.N2(g)+3H2(g)2NH3(g) ΔH=-Q1 kJ·mol-1(Q1>0)
B.2SO3(g)2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
C.4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
D.H2(g)+CO(g)C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学设计可如图所示的探究原电池的装置.下列有关说法正确的是( )
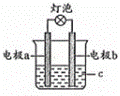
A. 电极材料必须是金属材料
B. 若a极为铜条、b极为锌片,c为蔗糖溶液时,灯泡会发亮
C. 若a极为铝条、b极为铜片,c为浓硝酸溶液时,铜为负极
D. 若a极为铝条、b极为镁片,c为稀硫酸溶液时,铝为负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com