
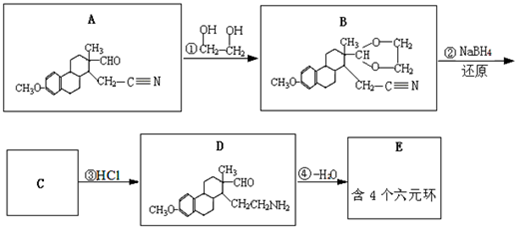
 (提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:A→B→C…→H.)
(提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:A→B→C…→H.)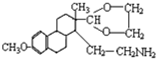 ,D为
,D为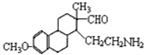 ,根据反应③在水溶液中进行,HCl是催化剂,结合C和D的结构简式分析;
,根据反应③在水溶液中进行,HCl是催化剂,结合C和D的结构简式分析;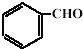 和
和 反应生成
反应生成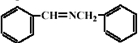 ,然后与HCN发生加成反应生成
,然后与HCN发生加成反应生成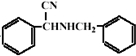 ,然后在酸性条件下可生成目标物.
,然后在酸性条件下可生成目标物. ,D为
,D为 ,根据反应③在水溶液中进行,HCl是催化剂,结合C和D的结构简式还有一种产物,该产物的名称是乙二醇,故答案为:乙二醇;
,根据反应③在水溶液中进行,HCl是催化剂,结合C和D的结构简式还有一种产物,该产物的名称是乙二醇,故答案为:乙二醇; ,故答案为:
,故答案为: ;
;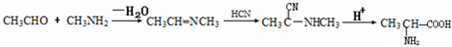 ,
,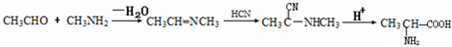 .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 0.01mol?L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol?L-1 Na2SO3溶液的体积/mL | H2O的体积/mL | 实验温度 /℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | t 1 |
| 实验2 | 5 | 5 | 40 | 25 | t2 |
| 实验3 | 5 | 5 | V2 | 0 | t 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制标准溶液所用的氢氧化钠已经潮解 |
| B、滴定终点读数时,俯视滴定管的刻度,其它操作均正确 |
| C、未用标准液润洗碱式滴定管 |
| D、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
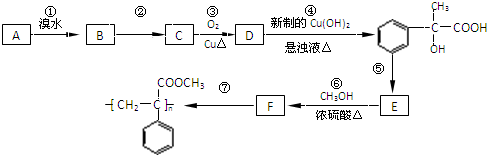
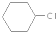 为原料合成重要的化工产品
为原料合成重要的化工产品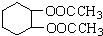 .合成路线流程图示例如下:
.合成路线流程图示例如下: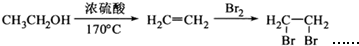 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、转移液体时,玻璃棒应紧靠容量瓶口 |
| B、容量瓶上标有温度、浓度、容积和压强 |
| C、将所需的6.0g氢氧化钠固体倒入到容量瓶中溶解 |
| D、定容时若俯视刻度线观察液面,会使所配制的NaOH 溶液的浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)+c(Na+)=c(HB-)+c(B2-)+c(OH-) |
| B、c(Na+)=0.1 moL/L≥c(B2-) |
| C、c(H+)×c(OH-)=1×10-14 |
| D、溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、OH-、Cl- |
| B、Al3+、SO42+、Na+、Cl- |
| C、Na+、Ba2+、Cl-、SO42- |
| D、Na+、Ca2+、HCO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com