
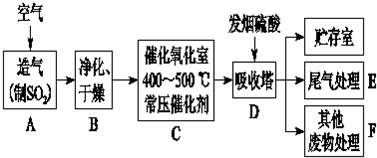
分析 工业制硫酸常用原料为硫铁矿、硫等,通入空气生成二氧化硫,二氧化硫经净化、干燥,在催化作用下生成三氧化硫,吸收塔D中用浓硫酸吸收三氧化硫,可得发烟硫酸,尾气、废弃物需经处理方可排放.
(1)反应4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2中,Fe元素化合价由+2价升高到+3价,S元素化合价由-1价升高到+4价;
(2)如用硫为原料,燃烧生成二氧化硫,利用率较高;
(3)生成0.1mol SO3,可放出9.83kJ的热量,则生成1molSO3放出98.3 kJ,以此书写热化学方程式;
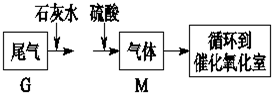
(4)尾气中含有二氧化硫,与石灰水反应生成亚硫酸钙,与硫酸反应生成硫酸钙和二氧化硫,可起到富集的目的;
(5)可结合电荷守恒、电荷守恒书写离子方程式.
解答 解:(1)12g FeS2的物质的量为,n(FeS2)=$\frac{12g}{120g/mol}$=0.1mol,反应4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2中,Fe元素化合价由+2价升高到+3价,S元素化合价由-1价升高到+4价,则0.1molFeS2共失去电子的物质的量为0.1mol×[(3-2)+2×(4-(-1)]=1.1mol,
故答案为:1.1;
(2)如用硫为原料,燃烧生成二氧化硫,可减少废弃物的排放,且利用率较高,故答案为:提高原料的利用率;
(3)生成0.1mol SO3,可放出9.83kJ的热量,则生成1molSO3放出98.3 kJ,热化学方程式为SO2(g)+$\frac{1}{2}$O2(g)═SO3(g)△H=-98.3 kJ/mol,
故答案为:SO2(g)+$\frac{1}{2}$O2(g)═SO3(g)△H=-98.3 kJ/mol;
(4)尾气中含有二氧化硫,与石灰水反应生成亚硫酸钙,反应的离子方程式为SO2+Ca2++2OH-═CaSO3↓+H2O,与硫酸反应生成硫酸钙和二氧化硫,可起到富集的目的,
故答案为:富集SO2;SO2+Ca2++2OH-═CaSO3↓+H2O;
(5)在含砷废水中加入一定数量的硫酸亚铁,然后加碱调pH至8.5~9.0,反应温度90℃,鼓风氧化,废水中的砷、铁以砷酸铁沉淀析出,反应的离子方程式为4As3++4Fe2++3O2+20OH-$\frac{\underline{\;\;△\;\;}}{\;}$4FeAsO4↓+10H2O,
故答案为:4As3++4Fe2++3O2+20OH-$\frac{\underline{\;\;△\;\;}}{\;}$4FeAsO4↓+10H2O.
点评 本题考查物质的制备,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握相关物质的性质以及热化学方程式的书写,题目有利于培养学生良好的科学素养,提高学习的积极性,难度中等.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
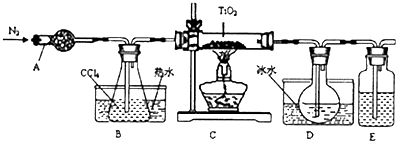
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤、蒸发、结晶、溶解 | B. | 溶解、蒸发、结晶、过滤 | ||
| C. | 溶解、蒸发、过滤、结晶 | D. | 溶解、过滤、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
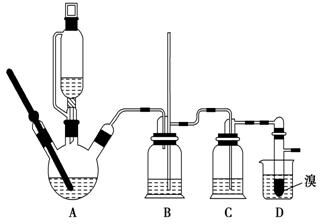 实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2+H2O CH2═CH2+Br2→BrCH2CH2Br
实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2+H2O CH2═CH2+Br2→BrCH2CH2Br| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
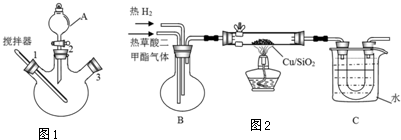
| 物质 | 熔点 | 沸点 | 水溶性 | 相对分子质量 |
| 乙二醇 | -12.9℃ | 197.3℃ | 溶于水、醇 | 62 |
| 甲醇 | -97℃ | 64.7℃ | 与水互溶 | 32 |
| 草酸二甲酯 | 54℃ | 163.5℃ | 微熔于冷水,溶于醇和醚 | 118 |
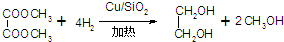
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
 | 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀, 4.黄绿色褪去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com