
| A、1 | B、2 | C、3 | D、4 |


科目:高中化学 来源: 题型:
| A、自然界中“氮的固定” |
| B、用铂丝蘸取NaCl溶液进行焰色反应 |
| C、食物腐败变质 |
| D、铜铸塑像上出现铜绿[Cu2(OH)2CO3] |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、工业合成氨:N2+3H2
| |||
B、工业合成盐酸:H2+Cl2
| |||
C、工业获取氯化钠:2Na+Cl2
| |||
D、工业制取氯气:2NaCl+2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
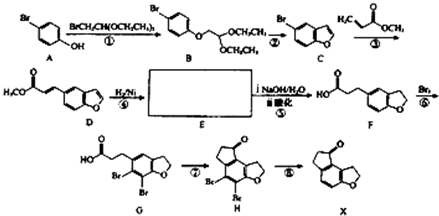
查看答案和解析>>
科目:高中化学 来源: 题型:
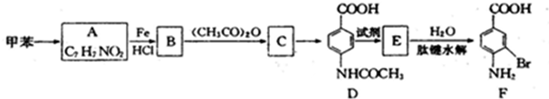
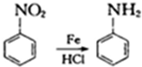
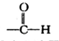 ②苯环上有两个取代基,且处于对位
②苯环上有两个取代基,且处于对位查看答案和解析>>
科目:高中化学 来源: 题型:
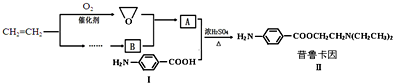
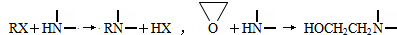
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、发生析氢腐蚀 |
| B、铁粉作阴极发生氧化反应 |
| C、含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
| D、可以吸热,从而降低温度,起保鲜糕点的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
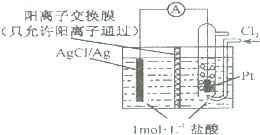
| A、正极反应为Cl2-2e-=2Cl- |
| B、放电时H+从右侧经阳离子交换膜移向左侧 |
| C、电路中转移0.01 mole-时,交换膜左侧溶液中减少0.01 mol离子 |
| D、若用NaCl溶液代替盐酸,电池的总反应不会改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
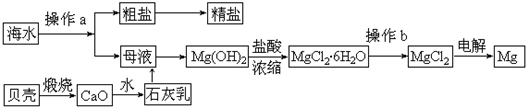
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com