
【题目】某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为_____.
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL 蒸馏水,振荡,恢复至室温,发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论_____.
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中.

①两试管中均产生气体,_____(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是_____.
a 装置 I的气球体积较大 b 装置Ⅱ的气球体积较大
c 装置 I的气球体积等于装置Ⅱ的气球体积 d 无法判断
(4)同学们将两种固体分别配制成0.5molL﹣1的溶液,设计如下方案并对反应现象做出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2mL Na2CO3溶液中滴加1mL 0.5molL﹣1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32﹣浓度较大,能与CaCl2发生反应__________(写离子方程式). |
操作2:向2mL NaHCO3溶液中滴加1mL 0.5molL﹣1CaCl2溶液 | 无白色沉淀 | Na2CO3溶液中的CO32﹣浓度很小,不能与CaCl2发生反应。 |
操作1反应的离子方程式为________________,实施试验后,发现操作2的现象与预测有差异,产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为____________.
【答案】 同温度下,Na2CO3比NaHCO3易溶于水 Ⅰ a Ca2++CO32-=CaCO3↓ Ca2++CO32-=CaCO3↓ Ca2++2HCO3-=CaCO3↓+CO2↑+H2O
同温度下,Na2CO3比NaHCO3易溶于水 Ⅰ a Ca2++CO32-=CaCO3↓ Ca2++CO32-=CaCO3↓ Ca2++2HCO3-=CaCO3↓+CO2↑+H2O
【解析】
(1)碳酸钠稳定,受热难分解,碳酸氢钠热稳定性差,受热易分解,生成二氧化碳气体,二氧化碳和氢氧化钙反应生成碳酸钙沉淀;
(2)①常温下,同质量、同体积的溶剂,Na2CO3固体完全溶解,而NaHCO3固体有剩余,说明Na2CO3较NaHCO3易溶;
(3)①同等条件下,碳酸钠与盐酸反应速率不及碳酸氢钠与盐酸反应;②等质量的Na2CO3和NaHCO3,NaHCO3物质的量较大,生成二氧化碳多,根据n=m/M算1g碳酸钠和碳酸氢钠的物质的量,根据化学方程式和盐酸的物质的量判断那种物质不足,生成气体的体积可根据不足的物质计算。
(1)碳酸钠稳定,受热难分解,碳酸氢钠热稳定性差,受热易分解,生成二氧化碳气体,二氧化碳和氢氧化钙反应生成碳酸钙沉淀,故A为碳酸氢钠,A分解反应方程式![]()
(2)常温下,同质量、同体积的溶剂,同质量Na2CO3固体完全溶解,而NaHCO3固体有剩余,说明Na2CO3较NaHCO3易溶,故答案为:同温度下,Na2CO3比NaHCO3易溶于水;
(3)①将气球内的固体同时倒入试管发生反应:Na2CO3+2HCl═2NaCl+H2O+CO2↑,NaHCO3+HCl═NaCl+H2O+CO2↑,同等条件下,碳酸钠与盐酸反应速率不及碳酸氢钠与盐酸反应,所以I的反应程度更为剧烈,故答案为:Ⅰ;
②a.Na2CO3的摩尔质量为:106g/mol,物质的量为1/106mol;NaHCO3的摩尔质量为:84g/mol,物质的量为1/84mol,盐酸的物质的量为3 10-31=0.003mol,由方程式Na2CO3+2HCl═2NaCl+H2O+CO2↑和NaHCO3+HCl═NaCl+H2O+CO2↑知盐酸不足,生成二氧化碳的量由盐酸决定,两试管中盐酸的量相同,所以装置 I的气球体积大于装置Ⅱ的气球体积,故选a;
(4)操作1:碳酸钠能和氯化钙反应CaCl2+Na2CO3═CaCO3↓+2NaCl,离子反应为:Ca2++CO32-=CaCO3↓,故答案为:Ca2++CO32-=CaCO3↓;
操作2:CaCl2与NaHCO3溶液反应生成沉淀和气体,可发生反应为CaCl2+2NaHCO3=CaCO3↓+2NaCl+CO2↑+H2O,离子反应为Ca2++2HCO3-=CaCO3↓+CO2↑+H2O,故答案为:Ca2++2HCO3-=CaCO3↓+CO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】向含S2﹣、Fe2+、Br﹣、I﹣各0.1mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量关系图正确的是( )
A. B.
B.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Al3+、Fe3+、Cu2+、Ba2+、K+和五种阴离子NO![]() 、OH-、Cl-、CO32—、Xn-(n=1或2)中的一种。
、OH-、Cl-、CO32—、Xn-(n=1或2)中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是____和______。
(2)物质C中含有离子Xn-。为了确定Xn-,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体(无气体生成),则C为___。(填名称)
(3)将38.4g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,则物质D为_________(化学式),写出Cu溶解的离子方程式_______,若要将Cu完全溶解,至少加入H2SO4的物质的量是_________。
(4)足量E溶液与氢碘酸反应时可生成使淀粉变蓝的物质,该反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 pH=5时沉淀完全).其中分析错误的是

A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②不能用氯水、硝酸等强氧化剂代替H2O2
C. 步骤④为过滤,步骤⑤蒸发结晶
D. 步骤③用 CuCO3代替CuO也可调节溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。

完成下列填空(填元素符号或化学式):
(1)元素B在元素周期表中的位置是第____周期第_____族,A、B、C三种元素原子半径从大到小的顺序是_________________;
(2)D简单离子的结构示意图为_____________,D、E中金属性较强的元素是________。D单质在空气中燃烧可生成淡黄色粉末X(D2O2),X常用作呼吸面具和潜水艇中的供氧剂,可选用合适的化学试剂和下图所示实验装置证明X有提供氧气的作用。
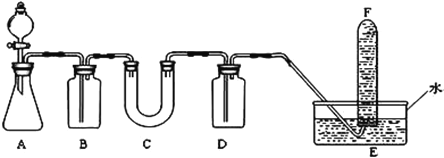
(3)装置A使用石灰石与浓盐酸反应制取CO2,装置B中饱和NaHCO3溶液的作用是除去_____________;
(4)装置C中X与CO2反应的化学方程式是_____________________,装置D盛放NaOH溶液的作用是除去____________;
(5)为检验试管F收集的气体,进行____________操作,出现_________现象,即证明X可作供氧剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
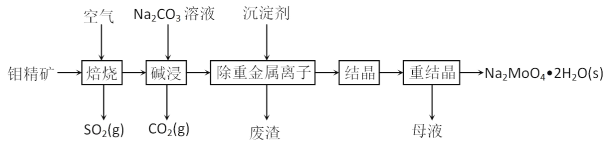
回答下列问题:
(1)提高焙烧效率的方法有_______________________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为____________________,氧化产物是__________________
(3)“碱浸”时生成CO2的电子式为______________,碱浸”时含钼化合物发生的主要反应的离子方程式为____________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为____________________。
(5)钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体.在合适反应条件下,它们可以按下面框图进行反应;又知D溶液为黄色,E溶液为无色.请回答:

(1)B是_____,F是_____(请填写化学式);
(2)反应③的离子方程式_____;
(3)反应④的离子方程式_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeCl3溶液中滴加2滴KSCN溶液,发生反应达到平衡Ⅰ。保持温度不变,仅改变某一个条件达到平衡Ⅱ,两次平衡时各物质的浓度如下:
Fe3+(aq)+3SCN-(aq)![]() Fe(SCN)3(aq)
Fe(SCN)3(aq)
平衡Ⅰ/(mol·L-1) a b c
平衡Ⅱ/(mol·L-1) x y z
下列叙述不正确的是( )
A. 存在关系式:c/ab3=z/xy3
B. 存在关系式:(a-x)∶(b-y)∶(z-c)=1∶3∶1
C. 向溶液中加入少量铁粉,溶液颜色变浅
D. 当溶液中c(SCN-)保持不变时达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数用NA表示,气体摩尔体积用Vm表示,物质的质量用m表示,请回答下列问题:
(1)n=![]() =
=![]() =
=![]() ,①②③处分别补充为___、___、___。
,①②③处分别补充为___、___、___。
(2)一个铜原子的质量为m’g,铜的相对原子质量为M’,则阿伏加德罗常数NA=___mol-1。(列出表达式,下同)
(3)常温下20滴水约为1mL,水的密度为1g·mL-1,每滴水中约含a个水分子,则阿伏加德罗常数NA=___mol-1。
(4)bgH2中含N个氢分子,则阿伏加德罗常数NA=___mol-1。
(5)在标准状况下,VLO2中含有N个氧原子,则阿伏加德罗常数NA=___mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com