
| A. | FeC13和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 | |
| B. | 其他条件不变,向稀H2SO4与过量Zn的混合物中加少量铜片,既能增大H2生成速率,又能减小生成H2的物质的量 | |
| C. | 其他条件不变,加热或加压都能使H2(g)+I2(g)?2HI(g)的v正和v逆同时增大 | |
| D. | v=$\frac{△c}{△t}$是化学上表示化学反应速率的唯一方法 |
分析 A.不同的催化剂催化效果不同;
B.向稀H2SO4与过量Zn的混合物中加少量铜片,形成Zn-Cu原电池,增大H2生成速率,但生成H2的物质的量不变;
C.加热或加压都能同时增大正逆反应速率;
D.反应速率之比还等于系数之比.
解答 解:A.不同的催化剂的催化效果不一定相同,所以同等条件下二者对H2O2分解速率的改变不一定相同,故A错误;
B.稀H2SO4与过量Zn的混合物中加少量铜片,形成Zn-Cu原电池,增大H2生成速率,又稀硫酸量不变,锌过量,所以生成H2的物质的量不变,故B错误;
C.加热或加压都能同时增大正逆反应速率,所以其他条件不变,加热或加压都能使H2(g)+I2(g)?2HI(g)的v正和v逆同时增大,故C正确;
D.反应速率之比还等于系数之比,所以还可以根据反应体系中一种物质的反应速率计算其他反应速率,故D错误,
故选C.
点评 本题考查影响反应速率的因素的分析,难度不大,注意基础知识的积累.


科目:高中化学 来源: 题型:实验题
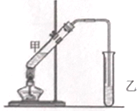 酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如下图所示的装置制取乙酸乙酯.回答下列问题:
酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如下图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| B. | 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- | |
| C. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| D. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐或碳酸氢盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
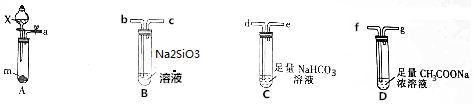
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 活性炭 | NO | N2 | X | |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
| A. | 气体X的化学式为CO2 | |
| B. | T1℃时的平衡常数K1=$\frac{9}{32}$ | |
| C. | 根据上述信息判断,T1>T2 | |
| D. | T1℃时,向平衡体系中继续加入活性炭,可提高NO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热46.3 kJ |
| ② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
| A. | 容器①中达到平衡时,Y2的转化率为50% | |
| B. | Q=27.78kJ | |
| C. | 容器①、②中反应的平衡常数相等,K=$\frac{16}{27}$ | |
| D. | 相同温度下;起始时向容器中充入1.0X2mol、3.0molY2和2molXY3;反应达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c1:c2=1:3 | |
| B. | 当4v(X)正=v(Y)逆时,该反应还在向逆反应方向建立平衡 | |
| C. | X、Y的转化率不相等 | |
| D. | Y起始浓度c2可能为0.36mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热为192.9kJ/mol | |
| B. | 反应①要吸收热量,故反应②更实用些 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com