

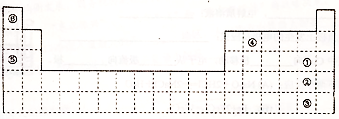
分析 根据元素在周期表中的位置知,A为H,B为Li,C为C,D为N,E为O,F为F,G为Na,H为Mg,I为Al,J为Si,K为S,L为Cl,M为Cr,N为Fe,O为Co,R为He,T为Ne,
(1)H单质是镁,镁在二氧化碳中燃烧生成氧化镁和C;
(2)D的气态氢化物是氨气,氨气分子中N原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论判断VSEPR模型和原子杂化方式;
(3)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(4)由A、C、D形成的ACD分子中为HCN,其结构式为H-C≡N,共价单键为σ键、共价三键中含有一个σ键、两个π键;
(5)采用光谱分析可以确定元素;
(6)M是Cr元素,其原子最外层有1个电子;非极性分子的溶质极易溶于非极性分子的溶剂;
(7)O为Co,中心离子钴离子的配位数是6,1mol该物质与足量的硝酸银反应可生成3molAgCl,说明该物质中氯元素是外界,为氯离子,则氨气分子和水分子为配体;
(8)N为Fe,利用均摊法计算晶胞中原子数目,根据$ρ=\frac{m}{V}$计算体心立方晶胞和面心立方晶胞中铁的密度之比;
解答 解:根据元素在周期表中的位置知,从A-R分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Cr、Fe、He元素,
(1)H单质是镁,镁在二氧化碳中燃烧生成氧化镁和C,方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(2)D的气态氢化物是氨气,氨气分子中N原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论知VSEPR模型为四面体,N原子杂化方式为sp3,
故答案为:四面体;sp3;
(3)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能Mg>Al>Na,
故答案为:Mg>Al>Na;
(4)由A、C、D形成的ACD分子中为HCN,其结构式为H-C≡N,共价单键为σ键、共价三键中含有一个σ键、两个π键,所以该分子中含有两个σ键、两个π键,
故答案为:2;2;
(5)采用光谱分析可以确定元素,所以可以采用光谱分析确定He元素,
故答案为:对太阳光进行光谱分析;
(6)M是Cr元素,其原子最外层有1个电子,所以与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有K、Cu,非极性分子的溶质极易溶于非极性分子的溶剂,溶质都是非极性分子,所以MO2Cl2是非极性分子,
故答案为:K、Cu;非极性;
(7)O为Co,中心离子钴离子的配位数是6,1mol该物质与足量的硝酸银反应可生成3molAgCl,说明该物质中氯元素全部是外界,为氯离子,则氨气分子和水分子为配体,其化学式为[Co(NH3)5 H2O]Cl3,
故答案为:NH3、H2O;
(8)N为Fe,设铁原子的半径为a,利用均摊法可知,体心立方晶胞中含有的铁原子数为$1+8×\frac{1}{8}$=2,体心立方晶胞的边长为$\frac{4a}{\sqrt{3}}$,所以晶胞的体积为($\frac{4a}{\sqrt{3}}$)3,则体心立方晶胞的密度为$\frac{\frac{2×56}{{N}_{A}}}{(\frac{4a}{\sqrt{3}})^{3}}$,面心立方晶胞中含有的铁原子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,面心立方晶胞的边长为$\frac{4a}{\sqrt{2}}$,所以晶胞的体积为($\frac{4a}{\sqrt{2}}$)3,则面心立方晶胞的密度为$\frac{\frac{4×56}{{N}_{A}}}{(\frac{4a}{\sqrt{2}})^{3}}$,所以体心立方晶胞和面心立方晶胞中铁的密度之比为$\frac{\frac{2×56}{{N}_{A}}}{(\frac{4a}{\sqrt{3}})^{3}}$:$\frac{\frac{4×56}{{N}_{A}}}{(\frac{4a}{\sqrt{2}})^{3}}$=$3\sqrt{3}:4\sqrt{2}$≈34:37,
故答案为:34:37.
点评 本题考查物质结构和性质,涉及原子杂化方式判断、相似相溶原理、元素周期律、物质性质等知识点,侧重考查基本理论,熟悉价层电子对互斥理论、元素周期律即可解答,注意第一电离能中的异常现象,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 冰融化时,分子中氢氧键发生断裂 | |
| B. | 原子晶体中共价键越强,熔点和沸点越高 | |
| C. | 分子晶体中共价键键能越大,该分子晶体的熔点和沸点一定也越高 | |
| D. | 分子晶体中分子间作用力越大,该物质越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)若利用如图装置制备纯净、干燥的氯气,装置A中反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.则装置B中的液体是饱和NaCl溶液;装置C中试剂的作用是干燥氯气
(1)若利用如图装置制备纯净、干燥的氯气,装置A中反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.则装置B中的液体是饱和NaCl溶液;装置C中试剂的作用是干燥氯气查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL 0.4mol/L硝酸 | B. | 10mL 0.2mol/L硫酸 | ||
| C. | 10mL 0.2mol/L盐酸 | D. | 50mL 0.1mol/L盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH-CH═CH2 1,3-二丁烯 | B. | 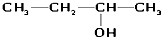 3-丁醇 3-丁醇 | ||
| C. |  甲基苯酚 甲基苯酚 | D. |  2-甲基丁烷 2-甲基丁烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com