
| 元素编号 | 元素性质或原子结构 |
| T | M层的电子数为K层电子数的3倍 |
| X | 其氢化物的空间构型为正四面体 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
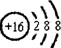 ;元素X的最高价氧化物的电子式
;元素X的最高价氧化物的电子式
分析 短周期元素,T的M层的电子数为K层电子数的3倍,则T的M层含有6个电子,T为S元素;X的氢化物的空间构型为正四面体,则X为C元素;Y常温下单质为双原子分子,其氢化物水溶液呈碱性,则Y为N元素;Z元素最高正价是+7价,则为第VIIA元素,由于F没有最高正价,所以Z为Cl元素;然后利用元素及其单质、化合物的性质来解答.
解答 解:短周期元素,T的M层的电子数为K层电子数的3倍,则T的M层含有6个电子,T为S元素;X的氢化物的空间构型为正四面体,则X为C元素;Y常温下单质为双原子分子,其氢化物水溶液呈碱性,则Y为N元素;Z元素最高正价是+7价,则为第VIIA元素,由于F没有最高正价,所以Z为Cl元素;
(1)T为S元素,硫离子核外有18个电子,其离子结构示意图为: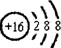 ;X的最高价氧化物为二氧化碳,其电子式为
;X的最高价氧化物为二氧化碳,其电子式为 ;
;
故答案为: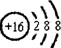 ;
; ;
;
(2)Y为N元素,N元素位于第二周期第ⅤA族,该元素的最高价氧化物对应水化物与其氢化物能生成盐硝酸铵,硝酸铵中含有的化学键类型有离子键和共价键;
故答案为:二;ⅤA;离子键、共价键;
(3)元素的非金属性越强,其最高价氧化物水化物的酸性越强,几种元素中非金属性最强的是Cl,其最高价氧化物水化物为HClO4;
故答案为:HClO4;
(4)同周期自左而右,非金属性增强,故非金属Cl>S,Z的氢化物比T的氢化物稳定则说明Z的非金属性强,
a.常温下Z的单质和T的单质状态不同,状态属于物理性质,不能据此判断非金属性,故错误;
b.氢化物越稳定,元素的非金属性越强,Z的氢化物比T的氢化物稳定,说明Z的非金属性比T强,故正确;
c.最高价氧化物所对应的水化物的酸性越强,元素的非金属性越强,Z的最高价氧化物所对应的水化物比T的最高价氧化物所对应的水化物的酸性强,说明Z的非金属性比T强,故正确;
d.溶解度属于物理性质,Z的氢化物比T的氢化物溶解度大,不能说明Z的非金属性比T强,故错误;
e.元素的非金属性越强,其单质与氢气化合越容易,Z的单质与H2化合比 T的单质与H2化合更容易,说明Z的非金属性比T强,故正确;
故答案为:Cl;bce;
(5)含有34个电子的C元素的氢化物的分子式为C4H10,故答案为:C4H10;
(6)实验室用浓盐酸与二氧化锰在加热条件下反应制备氯气,其反应的方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(7)同周期从左到右阴离子的半径逐渐减小,则离子半径:S2->Cl-,故答案为:S2->Cl-.
点评 本题考查位置、结构、性质的应用,元素的推断是解答本题的关键,侧重于考查学生的分析能力和对基础知识的应用能力,题目难度中等.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
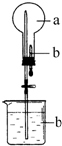 在如图所示的烧瓶中充满干燥气体a,胶头滴管及烧杯中分别盛有液体b.下列a与b的组合中,不可能形成喷泉的是( )
在如图所示的烧瓶中充满干燥气体a,胶头滴管及烧杯中分别盛有液体b.下列a与b的组合中,不可能形成喷泉的是( )| A. | NO2和H2O | B. | SO2和NaOH溶液 | ||
| C. | NH3和H2O | D. | CH4、Cl2混合气和饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
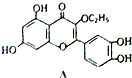
| A. | A的分子式为C17H14O7 | |
| B. | 一个A分子中含有三个苯环且A分子中无手性碳原子 | |
| C. | A可用有机溶剂萃取 | |
| D. | 1molA与足量的NaOH 溶液反应,最多可以消耗4molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属元素原子最外层都只有1个电子 | |
| B. | 依Li、Na、K、Rb,单质熔沸点升高,密度增大 | |
| C. | 单质氧化性:F2>Cl2>Br2>I2 | |
| D. | 氢化物稳定性:HF>HCl>HBr>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中: Fe+Cu2+═Cu+Fe2+ | 将Na加入到CuSO4溶液中: 2Na+Cu2+═Cu+2Na+ |
| B | 向稀硫酸溶液中加入NaOH溶液至中性:H++OH-═H2O | 向稀H2SO4溶液中加入Ba(OH)2溶液至中性:H++OH-═H2O |
| C | 向有水垢的瓶胆内加入足量稀盐酸溶液: CaCO3+2H+═Ca2++CO2↑+H2O | 向有水垢的瓶胆内加入足量醋酸溶液: CaCO3+2H+═Ca2++CO2↑+H2O |
| D | 向Ca(OH)2溶液中通入过量CO2: CO2+OH-═HCO3- | 向Ca(OH)2溶液中通入过量SO2: SO2+OH-═HSO3- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
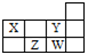
| A. | 1个37W原子中,质子数比中子数多3个 | |
| B. | Y和W处于同一主族,具有相同的最高价态 | |
| C. | Z形成简单阴离子半径小于W形成简单阴离子半径 | |
| D. | X与Y、Z与W每组两种元素间均可形成电子数相等的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:r(Z)>r(M)>r(N)>r(Y)>r(X) | B. | 元素的负电性:Y>N>X>Z | ||
| C. | 元素的第一电离能:I1(M)>I1(Z)>I1(X) | D. | 原子中的为成对电子数:N>Y>Z>M |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com