
| 物 质 | 杂 质 | 试剂 | 提 纯 方 法 | |
| A | BaSO4 | BaCO3 | 水 | 溶解、过滤、洗涤 |
| B | CO2 | SO2 | 饱和Na2CO3溶液 | 洗气 |
| C | 乙酸乙酯 | 乙酸 | 稀NaOH溶液 | 混合振荡、静置分液 |
| D | 蛋白质 | 葡萄糖 | 浓(NH4)2SO4溶液 | 溶解、过滤、洗涤 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、BaSO4、BaCO3均不溶于水;
B、饱和Na2CO3溶液能吸收CO2;
C、稀NaOH溶液能使乙酸乙酯水解;
D、浓的铵盐溶液能使蛋白质发生盐析.
解答 解:A、BaSO4、BaCO3均不溶于水,故加水不能除去BaCO3,故A错误;
B、饱和Na2CO3溶液不但能和二氧化硫反应,也能吸收CO2,故不能用饱和Na2CO3溶液吸收二氧化硫,故B错误;
C、稀NaOH溶液能使乙酸乙酯水解,故不能用氢氧化钠溶液除去乙酸,故C错误;
D、浓的铵盐溶液能使蛋白质发生盐析沉淀出来,故加入浓(NH4)2SO4溶液能将蛋白质沉淀出来,然后过滤出蛋白质,再加水稀释使蛋白质溶解即可,故D正确.
故选D.
点评 本题考查了物质的分离和除杂,根据物质和杂质性质的不同点来选择合适的除杂试剂,难度不大.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 增大压强 | B. | 降低温度 | ||
| C. | 增大水蒸气的浓度 | D. | 增大CO的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以上四种元素的原子半径大小为WXYZ | |
| B. | X的氢化物与水分子之间可形成氢键 | |
| C. | 已知Z-Cl键能比X-Cl键能小,所以Z的最简单氯化物比X的最简单氯化物沸点低 | |
| D. | W与Y可形成既含共价键又含离子键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
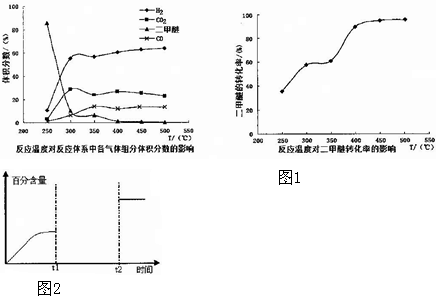
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 加热0.1 mol.L-l NaC1O溶液测其pH,pH小于9.7 | |
| B. | 0.lmo1.L-1Na2CO3溶液中,存在如下关系:c(OH-)-c(H+)=c(HCO3)+2c(H2CO3) | |
| C. | 根据上表数据得出四种酸电离平衡常数大小关系为:HF>HC1O>H2CO3(一级电离平衡常数) | |
| D. | pH=2的HF溶液与pH=12的NaOH溶液体积比1:1混合,则有c(Na+)=c(F-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
A | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化放出大量的热 |
| B | 用氢氟酸蚀刻玻璃 | SiO2是碱性氧化物,能溶于酸 |
| C | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | 用浸有酸性高锰酸钾溶液的硅藻 土作水果保鲜剂 | 酸性高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
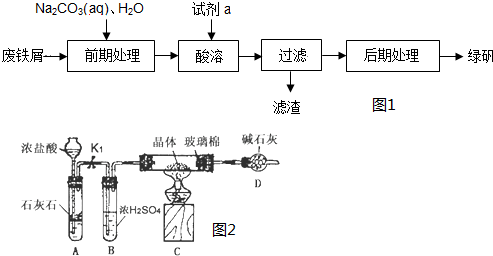
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
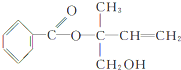 ,则下列有关说法正确的是( )
,则下列有关说法正确的是( )| A. | X的分子式为C12H16O3 | |
| B. | X在一定条件下能发生加成、加聚、取代、消去等反应 | |
| C. | 可用酸性高锰酸钾溶液区分苯和X | |
| D. | 在Ni作催化剂的条件下,1molX最多只能与1molH2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 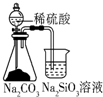 用如图可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 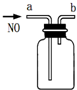 用如图装置收集一瓶纯净的NO | |
| C. |  用如图装置中U型管两端有液面差且保持不变时证明装置不漏气 | |
| D. | 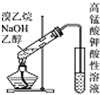 用如图检验溴乙烷与NaOH的醇溶液共热产生的乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com