
| A. | 1:9 | B. | 9:1 | C. | 1:11 | D. | 11:1 |
分析 溶液中PH=-lgc(H+),pH=3的强酸溶液中c(H+)=0.001mol/L,pH=12的强碱溶液中c(OH-)=0.01mol/L,混合所得溶液pH=10,混合溶液呈碱性,溶液中c(OH-)=0.0001mol/L,设溶液的体积为x、y,根据氢氧根离子、氢离子的物质的量及混合后溶液体积计算.
解答 解:pH=3的强酸溶液中c(H+)=0.001mol/L,pH=12的强碱溶液中c(OH-)=0.01mol/L,混合后溶液中c(OH-)=0.0001mol/L,
设酸溶液体积为x,碱溶液体积为y,则:$\frac{0.01mol/L×y-0.001mol/L×x}{x+y}$=0.0001mol/L,解得x:y=9:1,
故选B.
点评 本题考查了酸碱反应后溶液酸碱性判断计算,涉及溶液pH的计算、溶液中离子积的计算应用等,把握酸碱反应后碱过量是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
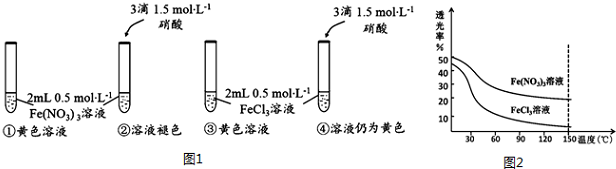
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1 的硫酸钾溶液中K+数为2NA | |
| B. | 3.2g氧气所含的原子数为0.2NA | |
| C. | 标准状况下,22.4L氢气所含质子数是2NA | |
| D. | 常温常压下,32g O2和32g O3所含氧原子数都是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
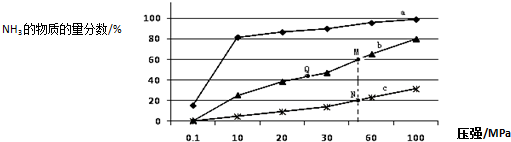
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做钠盐溶液的焰色反应时,用铂丝蘸取溶液放在酒精灯火焰上灼烧 | |
| B. | 分液时,下层液体先从分液漏斗下口放出,换一个接收容器,再将上层液体从分液漏斗下口放出 | |
| C. | 浓NaOH溶液沾到皮肤上,先用稀硫酸冲洗,再用水冲洗 | |
| D. | 用氨水清洗做过银镜反应的试管内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2N02(g)═N2(g)+C02(g)+2H2O(l)△H=-867 kJ.mol-1 | |
| B. | CH4催化还原1molNOx为N2的过程中,若x=1.5,则转移的电子总数为3×6.02×1021 | |
| C. | 若0.2 mol CH4还原N02至N2,在上述条件下吸收眵热迸为173.4 kJ | |
| D. | 若用4.48 LCH4还原N02至N2,整个过程中转移电子总数为1.6×6.02×1021 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
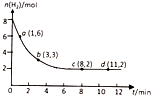
| A. | 升高温度,平衡常数将变大 | B. | 0~1min,v(CO2)=0.1mol/(L•min) | ||
| C. | 达到平衡时,氢气的转化率为75% | D. | 到达平衡时,甲醇的体积分数为20% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com