
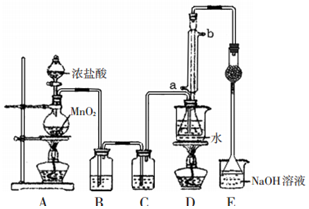
 S2Cl2是工业上常用的硫化剂,实验室利用反应:CS2+3Cl2=CCl4+S2Cl2来制备S2Cl2,反应装置如图所示(部分夹持装置省略).
S2Cl2是工业上常用的硫化剂,实验室利用反应:CS2+3Cl2=CCl4+S2Cl2来制备S2Cl2,反应装置如图所示(部分夹持装置省略).| 物质 | 沸点/℃ | 熔点/℃ |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
分析 制备S2Cl2原理是:在装置A中二氧化锰和浓盐酸之间反应得到氯气,但是氯气中混有HCl和水,应该先用饱和食盐水除去HCl(装置B),再用浓硫酸干燥氯气(装置C),让氯气和二硫化碳在一定温度下发生反应(装置D),为了使CS2平稳汽化,避免产物S2Cl2汽化,采用热水浴加热的方法,根据S2Cl2的熔沸点数据,采用冷凝回流的办法将之收集即可试验中的氯气要进行尾气处理,可以用氢氧化钠来吸收,据此分析作答.
解答 解:(1)用浓盐酸和二氧化锰反应制取氯气,反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)氯气中混有HCl和水,用饱和食盐水除去HCl(装置B),再用浓硫酸干燥氯气(装置C);
故答案为:吸收Cl2中的HCl气体;浓硫酸;
(3)水浴加热使受热均匀,温度更易控制;反应生成CCl4和S2Cl2,得到混溶在一起的混合物; 依据四氯化碳和S2Cl2 的沸点不同控制沸点分离;
故答案为:受热均匀,温度易控制;蒸馏;
(4)装置E中倒扣漏斗的作用是防止倒吸;
故答案为:防止倒吸;
(5)S2Cl2易与水反应,有淡黄色沉淀生成,说明有单质S生成,产生的无色气体能使品红溶液褪色,说明还有二氧化硫生成,则反应为:2S2Cl2+2 H2O=3S↓+SO2↑+4HCl;
故答案为:2S2Cl2+2 H2O=3S↓+SO2↑+4HCl.
点评 本题考查了物质的制备,涉及氯气的实验室制法、物质的分离除杂、实验的控制以及氧化还原反应等知识点,题目难度不大,关键是对基础的掌握,并能灵活运用.


科目:高中化学 来源: 题型:选择题
| A. | 此时,v (A):v (B):v (C):v (D)=4:3:2:1 | |
| B. | 该反应体系中气体的平均相对分子质量不变不可作为平衡标志 | |
| C. | 充入N2使压强增大可加快反应速率 | |
| D. | C的平均反应速率为:0.15mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ | B. | H2O2+H2SO4=SO2↑+O2↑+2H2O | ||
| C. | SO2+I2+2H2O=H2SO4+2HI | D. | 2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 83% | B. | 17% | C. | 50% | D. | 60% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 对环境的影响(或用途) | 解释 |
| A | 酒精用于环境消毒 | 酒精能使蛋白质变性 |
| B | 热碳酸钠溶液清除炊具上残留的油污 | 碳酸钠溶液水解显碱性 |
| C | SO2和NO2溶于水形成酸雨 | SO2和NO2是酸性氧化物 |
| D | 浸泡过酸性KMnO4溶液的硅藻土保鲜水果 | 酸性KMnO4溶液氧化乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 污染物 | 速度/(km•h-1) | |||
| 50 | 80 | 90 | 120 | |
| 一氧化碳/g | 8.7 | 5.4 | 4.7 | 9.6 |
| 氮的氧化物/g | 0.6 | 1.5 | 1.7 | 3.8 |
| 碳氢化合物/g | 0.7 | 0.6 | 0.5 | 0.8 |
| A. | 50 | B. | 80 | C. | 90 | D. | 120 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molN2所含有的原子数为NA | |
| B. | 标准状况下,16gNH3中含有的分子数为NA | |
| C. | 标准状况下,22.4L氯化氢所含的原子数为NA | |
| D. | 500ml 1.0mol•L-1硫酸钠溶液中所含的钠离子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com