
| A. | Ksp(AB2)<Ksp(CD),则物质AB2的溶解度一定小于物质CD的溶解度 | |
| B. | 在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大 | |
| C. | 在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银 | |
| D. | 在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动 |
分析 A.由于AB2与CD分子组成形式不同,因此不能根据Ksp大小来比较溶解度的大小;
B.KSP只与温度有关,与浓度无关;
C.由于AgCl与AgI分子组成形式相同,故Ksp越大,溶解度越大,溶解度大的能转化为溶解度小;
D.稀盐酸能与CO32-反应,促进碳酸钙的沉淀溶解平衡向正方向移动.
解答 解:A.由于AB2与CD分子组成形式不同,因此不能根据KSP大小来比较溶解度的大小,故A错误;
B.溶度积只受温度的影响,温度不变,则溶度积不变,故B错误;
C.由于AgCl与AgI分子组成形式相同,故Ksp越大,溶解度越大,溶解度大的能转化为溶解度小的,因为KSP(AgCl)大于KSP(AgI),故AgI的溶解度小,所以氯化银沉淀能转化为AgI黄色沉淀,故C正确;
D.碳酸钙的沉淀溶解平衡为:CaCO3(s)?Ca2+(aq)+CO32-(aq),加入盐酸能与CO32-反应,促进碳酸钙的沉淀溶解平衡向正方向移动,故D错误.
故选C.
点评 本题综合考查了Ksp的比较,沉淀的转化,影响Ksp的因素,沉淀溶解平衡的移动等,为高频考点,侧重于学生的分析能力的考查,题目难度不大.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:多选题
| A. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| B. | 常温常压下,46gNO2和N2O4的混合气体中含有的原子总数为3NA | |
| C. | 78gNa2S和Na2O2的混合物中阳离子和阴离子的总数为3.5NA | |
| D. | 标准状况下,2.24 L乙炔中含有共价键数目为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 2mol•L-1 KClO3溶液 | B. | 75mL 2mol•L-1CaCl2溶液 | ||
| C. | 150mL 2mol•L-1 KCl溶液 | D. | 75mL 1mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.20 | 0.10 | 0.09 | 0.08 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
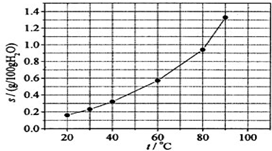
| A. | 温度升高时溴酸银溶解速度加快 | |
| B. | 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 | |
| C. | 60℃时溴酸银的Ksp约等于6×10-4 | |
| D. | 溴酸银的溶解是放热过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属元素单质的熔点随核电荷数增大而升高 | |
| B. | 同一周期元素的原子,半径越小越容易失去电子 | |
| C. | 第ⅥA族元素的氢化物相对分子质量越大,沸点越高 | |
| D. | 卤族元素的原子序数越大,其单质的沸点一定越高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com