

分析 (1)根据反应“2Ag+(aq)+Cu═Cu2+(aq)+2Ag”分析,在反应中,Cu被氧化,失电子,应为原电池的负极,电极反应为Cu-2e-=Cu2+,则正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,电解质溶液为AgNO3 ,原电池中,盐桥中的Cl-移向负极;若将盐桥换成铜丝,右边形成原电池,左边为电解池,银为正极,则X电极名称是阳极,由此分析解答;
(2)若X为碳棒,为减缓铁的腐蚀,应使Fe连接电源的负极,为电解池,据此书写离子方程式;
若X为锌,开关K置于M处,为原电池,Zn为负极被腐蚀,Fe为正极被保护.
解答 解:(1)根据反应“2Ag+(aq)+Cu═Cu2+(aq)+2Ag”分析,在反应中,Cu被氧化,失电子,应为原电池的负极,电极反应为Cu-2e-=Cu2+,则正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,电解质溶液为AgNO3 ,原电池中,盐桥中的Cl-移向负极CuSO4;若将盐桥换成铜丝,右边形成原电池,左边为电解池,银为正极,则X电极名称是阳极,故答案为:AgNO3,Cu-2e-=Cu2+,CuSO4,阳极;
(2)若X为碳棒,为减缓铁的腐蚀,应使Fe连接电源的负极,为电解池,所以开关K应置于N处,假设海水中只有NaCl溶质,则总离子反应为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,若X为锌,开关K置于M处,为原电池,Zn为负极被腐蚀,Fe为正极被保护,该电化学防护法称为牺牲阳极的阴极保护法,故答案为:N;2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;牺牲阳极的阴极保护法;
点评 本题考查了原电池和电解池原理,根据原电池中正负极上得失电子及电极反应式来分析解答即可,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
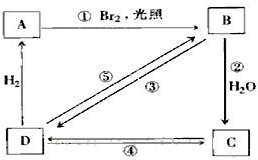 下列框图中B、C、D都是相关反应中的主要产物或反应物(部分条件、试剂被省略),且化合物B分子中仅有4个碳原子、1个溴原子、1种氢原子.
下列框图中B、C、D都是相关反应中的主要产物或反应物(部分条件、试剂被省略),且化合物B分子中仅有4个碳原子、1个溴原子、1种氢原子. ;D的系统命名的名称是:2-甲基丙烯
;D的系统命名的名称是:2-甲基丙烯查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2L氯化氢气体分解成1L的氢气和1L的氯气,吸收183kJ热量 | |
| B. | 1mol氢气与1mol氯气反应生成2mol液态氯化氢放出的热量小于183kJ | |
| C. | 在相同条件下,1mol氢气与1mol氯气的能量总和大于2mol氯化氢气体的能量 | |
| D. | 1个氢气分子与1个氯气分子反应生成2个氯化氢分子放出183kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上将石油蒸馏得到汽油,这主要发生了化学变化 | |
| B. | 区分蛋白质溶液和葡萄糖溶液可利用丁达尔效应 | |
| C. | 乙醇汽油是一种化合物,具有可燃性 | |
| D. | 食醋、纯碱、食盐的主要化学物质分别属于酸、碱、盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酚遇FeCl3溶液时立即显紫色,而醇不能 | |
| B. | 分子内有苯环和羟基的化合物一定是酚 | |
| C. | 含有羟基的化合物一定是醇 | |
| D. | 酚和醇具有相同的官能团,因而具有相同的化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 天气情况 | 平均风速(m/s) | 空气中SO2的平均含量(mg/L) |
| 雨前 | ||
| 雨后 | ||
| 晴 | ||
| 晴 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com