
【题目】按要求完成下列问题:
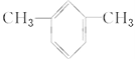
(1)乙酸乙酯的键线式 _________________;间二甲苯的结构简式 ____________________;![]() 的分子式 ______________________;
的分子式 ______________________;
(2)戊烷(C5H12)的某种同分异构体只有一种一氯代物,该烃的结构简式: __________;
(3)分子式为C4H9Cl的物质,有4种同分异构体,请写出这4种同分异构体的结构简式:___________, __________, __________, _________________。
【答案】![]()
 C7H12
C7H12 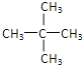 CH3CH2CHClCH3 CH3CH2CH2CH2Cl CH3CCl(CH3)CH3 CH3CH(CH3)CH2Cl
CH3CH2CHClCH3 CH3CH2CH2CH2Cl CH3CCl(CH3)CH3 CH3CH(CH3)CH2Cl
【解析】
(1)乙酸乙酯的结构简式为CH3COOCH2CH3,根据键线式的画法画出乙酸乙酯的键线式;苯环连接2个甲基且处于间位位置;根据键线式的画法判断出碳原子数目,结合碳的4价判断氢原子数目;
(2)先利用减链法书写同分异构体,然后根据一氯取代物的种类等于氢原子的种类写出结构简式;
(3)C4H10的同分异构体有:CH3CH2CH2CH3、CH3CH(CH3)CH3,分析其化学环境不同的H原子数目,再利用Cl原子替换H原子;
据此分析解答。
(1)乙酸乙酯的键线式为![]() ;间二甲苯中苯环连接2个甲基且处于间位,结构简式为:
;间二甲苯中苯环连接2个甲基且处于间位,结构简式为: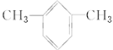 ;
; ![]() 的分子式为:C7H12,故答案为:
的分子式为:C7H12,故答案为:![]() ;
;![]() ; C7H12;
; C7H12;
(2)利用减链法书写同分异构体:所有的碳原子在一条链上:CH3-CH2-CH2-CH2-CH3;拿下1个碳原子作为支链:![]() ;拿下2个碳原子作为支链:
;拿下2个碳原子作为支链: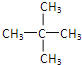 ;其中一种结构它的一氯代物只有一种结构,即只有一种氢原子,即为
;其中一种结构它的一氯代物只有一种结构,即只有一种氢原子,即为 ,故答案为:
,故答案为: ;
;
(3)C4H10的同分异构体有两种:CH3CH2CH2CH3、CH3CH(CH3)CH3;CH3CH2CH2CH3分子中有2种化学环境不同的H原子,其一氯代物有2种分别为:CH3CH2CHClCH3、CH3CH2CH2CH2Cl;CH3CH(CH3)CH3分子中有2种化学环境不同的H原子,其一氯代物有2种分别为:CH3CCl(CH3)CH3、CH3CH(CH3)CH2Cl,故答案为:CH3CH2CHClCH3、CH3CH2CH2CH2Cl、CH3CCl(CH3)CH3、CH3CH(CH3)CH2Cl。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

已知:①RCHO+CH3CHO ![]() RCH=CHCHO+H2O;②
RCH=CHCHO+H2O;②![]() 。
。
回答下列问题:
(1)C的结构简式为_______________________。
(2)F中官能团的名称为___________________。
(3)B与新制Cu(OH)2悬浊液反应的化学方程式为________________。
(4)从转化流程图可见,由D到E分两步进行,其中第一步反应的类型为__________。
(5)化合物G的二氯代物有__________种同分异构体。
(6)芳香化合物X是D的同分异构体,X能发生银镜反应,其核磁共振氢谱显示有3种化学环境的氢,峰面积之比为6∶1∶1,符合条件的X的结构共有多种,任写出2种符合要求的X的结构简式________、___________。
(7)写出用甲醛和乙醛为原料制备化合物CH2=CHCOOCH3的合成路线(其他试剂任选)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合所学内容,回答下列问题:
Ⅰ.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。草酸与酸性高锰酸钾的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。室温下,两支试管分别编号①和②,实验数据如下:
实验序号 | ① | ② |
加入试剂 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的MnSO4固体 |
褪色时间/s | 116 | 6 |
试管①中KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快。
请回答:
(1)该实验结论是___________________________________________________________。
(2)实验②选用MnSO4固体而不是MnCl2固体的原因是____________________________。
(3)该同学为使实验更加严密,在试管③中做了如下实验,请预测褪色时间约为_____。
实验序号 | ③ |
加入试剂 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的Na2SO4固体 |
褪色时间/s |
Ⅱ.滴定法是一种重要的定量分析方法,应用范围很广。某地市场上销售的一种食用精制盐包装袋上有如下部分说明:
产品等级 | 一级 |
配料 | 食盐、碘酸钾(KIO3)、抗结剂 |
碘含量(以I计) | 20~50 mg·kg-1 |
已知:IO3-+5I-+6H+ = 3I2+3H2O,I2+2S2O32- = 2I-+S4O62-某学生拟测定食用精制盐的碘含量,其步骤为
a.准确称取W g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.加入指示剂,逐滴加入物质的量浓度为2.0×10/span>-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全
(4)c中加入的指示剂可选用_________,恰好完全反应时的现象是_______________。
(5)若操作b在空气中振荡时间过长,则最终测定的测定食用精制盐中的的碘含量会__________(填“偏高”、“偏低”或“没有影响”)。
(6)根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)________mg·kg-1(计算结果保留整数即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
合成抗癌新药盐酸埃克替尼的关键中间体G的一种合成路线如下图:

已知:①A分子中只有一种化学环境的氢;
②TsCl为![]()
(1)A的结构简式为__________________。
(2)E的分子式为_____________;G中的含氧官能团的名称有___________。
(3)由E生成F的反应类型是________________。
(4)W是D的同分异构体.W是三取代芳香族化合物,既能发生银镜反应和水解反应,又能与FeC13溶液发生显色反应;1mol W最多可与4mol NaOH反应,W的同分异构体有______种;若W的核磁共振氢谱只有4组峰.则W的结构简式为:_____________。
(5)参照上述合成路线,以(![]() )和邻苯二酚为原料(其它试剂任选),设计制备的
)和邻苯二酚为原料(其它试剂任选),设计制备的 合成路线。_____________________________________
合成路线。_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.淀粉和纤维素互为同分异构体。
B.丙酸和甲酸甲酯互为同分异构体
C.乙烯和丙烯互为同系物
D.相差一个或若干个-CH2原子团的有机化合物一定互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构确定:
①测定实验式:某含C、H、O三种元素的有机物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,则其实验式是 __________________;
②确定分子式:如图是该有机物的质谱图,则其相对分子质量为 ____;分子式为 _____;

③结构式的确定:经测定,该有机物在核磁共振氢谱中出现四个峰,其氢原子个数比为6∶1∶2∶1;该有机物与金属钠反应产生氢气;则A的结构简式为 _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙酸丁酯的实验装置有如图甲、乙两种装置可供选用。

制备乙酸丁酯所涉及的有关物质的物理性质见下表:

(1)制取乙酸丁酯的装置应选用 ______(填“甲”或“乙”),不选另一种装置的理由是 ______;
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式)__________;
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,写出两种可行的方法:
① ______________________________② ____________________________________;
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是__________________(选填答案编号)。

(5)有机物的分离操作中,经常需要使用分液漏斗等仪器.使用分液漏斗前必须 _____,某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态 Cl原子核外电子排布式__________________________,P、S、Cl的第一电离能由大到小顺序
为____________________。
(2)SCl2分子中的中心原子杂化轨道类型是_____________,该分子构型为__________。
(3)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为__________。
(4)已知MgO与NiO的晶体结构(如图1)相同,其中Mg2+和Ni2+的离子半径分别为66 pm和69 pm。则熔点:MgO_____NiO(填“>”、“<”或“=”),理由是_____________。

(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为______。
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+ 填充其中(如图2),已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为______g。(用a、NA表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 用惰性电极电解CuSO4溶液一段时间后,若加入29.4gCu(OH)2能使溶液复原,则电解过程中转移电子的数目为0.9NA
B. 0.1molNa2O2与过量的CO2和H2O混合气体充分反应后,放出的O2为0.2NA
C. 常温常压下,1molSiO2晶体中有2NA个Si-O键
D. 18gH218O和2H2O的混合物中,所含中子数为9NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com