
�������ڡ�ʮ���塱�ڼ佫SO2���ŷ�������8%���о�SO2�ۺ����������ش�
��1����֪25��ʱ��SO2��g����2CO��g����2CO2��g���� Sx��s�� ��H��akJ/mol
Sx��s�� ��H��akJ/mol
2COS��g����SO2��g����2CO2��g���� Sx��s�� ��H��bkJ/mol��
Sx��s�� ��H��bkJ/mol��
��CO��Sx����COS��Ӧ���Ȼ�ѧ����ʽ��________________________��
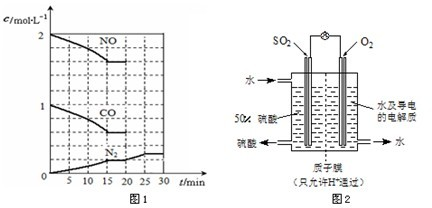
��2���������밴��ͼ��ʾװ���÷����е�SO2�������ᡣ

д��SO2�缫�ĵ缫��Ӧʽ__________________________��
��3����߷�Ӧ2SO2��g����O2��g��
 2SO3��g�� ��H��0��SO2��ת�����ǿ���SO2�ŷŵĹؼ���ʩ֮һ��ij����С�����������̽����
2SO3��g�� ��H��0��SO2��ת�����ǿ���SO2�ŷŵĹؼ���ʩ֮һ��ij����С�����������̽����
��T1�¶�ʱ����2L���ܱ������м���4.0molSO2��2.0molO2��5 min��Ӧ�ﵽƽ�⣬���������ת����Ϊ50%��ǰ5 min��SO2��ƽ����Ӧ����Ϊ___________��
���ڢ��еķ�Ӧ�ﵽƽ��ı�������������ʹSO2��ת���ʼ�SO3��ƽ��Ũ�ȶ���ԭ���������
_________������ţ���
a���¶Ⱥ�����������䣬����1.0molHe ��g��
b���¶Ⱥ�����������䣬����2molSO2��lmolO2
c���¶Ⱥ�����������䣬����1.0molSO2
d����������������ʱ����С�������ݻ�
���������������������£�̽����ʼʱ�������ʵ�����2SO2��g����O2��g��
 2SO3��g����Ӧ��Ӱ�죬ʵ������ͼ��ʾ����ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���������a��b��c����������ƽ��״̬�У�SO2��ת������ߵ���____���¶�T1______T2���������������������
2SO3��g����Ӧ��Ӱ�죬ʵ������ͼ��ʾ����ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���������a��b��c����������ƽ��״̬�У�SO2��ת������ߵ���____���¶�T1______T2���������������������

��1��CO��g���� Sx��s����COS��g�� ��H��
Sx��s����COS��g�� ��H�� kJ/mol��2�֣�
kJ/mol��2�֣�
��2��SO2��2e����2H2O��SO42����4H����2�֣�
��3����0.2mol��L��1��min��1��2�֣���λ��λ���÷֣� ��b d��2�֣���c��2�֣� ����2�֣�
��������
�������:��1��������֪��Ӧ��SO2��g����2CO��g����2CO2��g���� Sx��s�� ��H��akJ/mol����2COS��g����SO2��g����2CO2��g����
Sx��s�� ��H��akJ/mol����2COS��g����SO2��g����2CO2��g����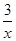 Sx��s�� ��H��bkJ/mol������ݸ�˹���ɿ�֪�����٣��ڣ���2���õ���ӦCO��g����
Sx��s�� ��H��bkJ/mol������ݸ�˹���ɿ�֪�����٣��ڣ���2���õ���ӦCO��g���� Sx��s����COS��g�������Ըõķ�Ӧ�ȡ�H��
Sx��s����COS��g�������Ըõķ�Ӧ�ȡ�H�� kJ/mol��
kJ/mol��
��2����װ����ԭ��أ������õ����ӣ�������ͨ�롣SO2ʧȥ���ӣ��ڸ���ͨ�롣ԭ������������������ƶ������ڴ������ӽ���Ĥ������������ڸ������ɣ�����SO2�缫�ĵ缫��ӦʽΪSO2��2e����2H2O��SO42����4H����
��3����5 min��Ӧ�ﵽƽ�⣬���������ת����Ϊ50%����Ӧ������SO2�����ʵ�����4mol��50��2mol����Ũ����2mol��2L��1mol/L������ǰ5 min��SO2��ƽ����Ӧ���ʣ� ��0.2mol/�� L��min����
��0.2mol/�� L��min����
��a���¶Ⱥ�����������䣬����1.0molHe ��g�������ʵ�Ũ�Ȳ��䣬ƽ�ⲻ�ƶ�������a����ȷ��b���¶Ⱥ�����������䣬����2molSO2��lmolO2�����൱��������ѹǿ��ƽ��������Ӧ�����ƶ�������SO2��ת���ʼ�SO3��ƽ��Ũ�ȶ���ԭ������b��ȷ��c���¶Ⱥ�����������䣬����1.0molSO2��ƽ��������Ӧ�����ƶ������������Ũ������SO2��ת���ʽ��ͣ�c����ȷ��d����������������ʱ����С�������ݻ���ѹǿ����ƽ��������Ӧ�����ƶ�������SO2��ת���ʼ�SO3��ƽ��Ũ�ȶ���ԭ������d��ȷ����ѡbd��
�۸���ͼ���֪��b��ʱ��������ĺ�����ߣ���������������Ũ��ƽ��������Ӧ�����ƶ���SO2��ת��������������a��b��c����������ƽ��״̬�У�SO2��ת������ߵ���c�㡣���ڸ÷�Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ�����������ĺ������͡�����ͼ���֪�������������ʵ�����ͬ������£�T2���߱�ʾ�������������ߣ�����¶���T1��T2��
���㣺�����Ȼ�ѧ����ʽ����д����Ӧ���ʵļ��㡢���������ƽ��״̬��Ӱ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| c(N2)?c2(CO2) |
| c2(CO)?c2(NO) |
| c(N2)?c2(CO2) |
| c2(CO)?c2(NO) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ��� |
| �ŵ� |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 1 |
| 2 |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ���Ŵ�����Ⱦ���������أ��������ڡ�ʮ���塱�ڼ䣬����������SO2���ŷ�������8%���������NOx���ŷ�������10%��Ŀǰ������������Ⱦ�ж��ַ�����
���Ŵ�����Ⱦ���������أ��������ڡ�ʮ���塱�ڼ䣬����������SO2���ŷ�������8%���������NOx���ŷ�������10%��Ŀǰ������������Ⱦ�ж��ַ�����Ũ��/mol?L-1 ʱ��/min |
NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com