
.某工厂用硫酸处理氨气尾气,得到铵盐(不同批次得到a、b、c三种不同的铵盐)。称取不同质量的铵盐,加入到固定量的NaOH溶液中并加热,收集氨气,得到如下生成氨气的量与加入铵盐的量关系图:
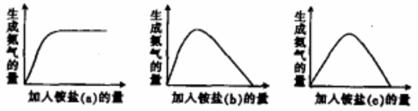
下列判断不正确的是:
A. a对应的铵盐是(NH4)2SO4
B. b对应的铵盐是(NH4)2SO4和NH4HSO4
C. c对应的铵盐是NH4HSO4
D. 当b和c铵盐的质量相同时,可得到相同量的氨气
【知识点】物质的性质 D4 D5
【答案解析】D解析:NH4+、H+与NaOH溶液反应的先后顺序是OH-首先是和NH4HSO4中的H+反应,随后有多余的OH-再和NH4+反应放出氨气,称取不同质量的铵盐,加入到固定量的NaOH溶液中并加热,收集氨气,
A、如果铵盐只有(NH4)2SO4,当铵盐相对于氢氧化钠为少量时,随着铵盐的量的增加放出的氨气量增加,当铵盐与氢氧化钠恰好完全反应时放出的氨气最多,当铵盐过量时,氨气的量也不在增加,故A正确;C、如果铵盐只有NH4HSO4,当NH4HSO4的物质的量是NaOH的1/2时放出的氨气最多,如果NH4HSO4的物质的量大于NaOH的1/2时放出的氨气反而减少,当NH4HSO4的物质的量与NaOH的物质的量相等时,只发生时H+与NaOH溶液反应,不会放出的氨气,故C正确;B、综合AB可知B正确D错误。
故答案选D
【思路点拨】本题考查了化学反应的先后顺序,解题的关键是NH4+、H+与NaOH溶液反应的先后顺序是OH-首先是和H+反应,随后有多的OH-再和NH4+反应放出氨气。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
下图是实验室中制备气体或验证气体性质的装置图

(1)写出用A制取氯气的化学方程式_________________________________________。
(2)利用上图装置制备纯净的氯气,并证明氧化性:Cl2>Fe3+
则装置B中的溶液的作用是___________________________________;
装置D中加的最佳试剂是(填序号)___________:
供选试剂:a.浓H2SO4 b.FeCl2溶液 c.KSCN与FeCl2的混合溶液 d.无水氯化钙
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
证明SO2具氧化性和漂白性:B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的__________(填溶液名称),E中加入___________溶液(填化学式)。
(4)证明碳元素的非金属性比硅元素的强的现象为______________________;
实验2不严谨之处应如何改进________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用如图所示装置进行下列实验,能得出相应实验结论的是
| 选项 | ① | ② | ③ | 实验结论 |
|
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
| B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 | |
| C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
| D | 稀盐酸 | Na2CO3 | Na2SiO3 | 非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X含有Ba2+、Al3+、NH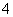 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO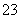 、SO
、SO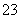 、SO
、SO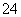 、Cl-、NO
、Cl-、NO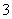 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:

根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是_____________________________________;
(2)写出有关离子方程式:
步骤①中生成A__________________;步骤②生成沉淀I__________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4NH3(g)+5O2(g)===4NO(g)+6H2O(g)在2 L密闭容器中进行1 分钟后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( )
A.NO:0.001mol·L-1
B.H2O:0.002mol·L-1
C.NH3:0.002mol·L-1
D.O2:0.0025mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中反应mA(g)nB(g)达到平衡后,保持温度不变,改变容器体积(V),B的浓度变化如图所示,以下判断正确的是( )

A.物质B的质量分数增大
B.平衡向逆反应方向移动
C.物质A的转化率减小
D.化学计量数:m>n
查看答案和解析>>
科目:高中化学 来源: 题型:
随着卤素原子半径的增大,下列递变规律正确的是()
A. 单质的熔点逐渐降低 B. 卤素离子还原性逐渐增强
C. 气态氢化物稳定性逐渐增强 D. 单质氧化性逐渐增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com