9.2g金属钠投入到足量的H2O中,则产生的气体中含有( )
A.0.2mol中子
B.0.4mol电子
C.0.2mol质子
D.0.4mol分子
【答案】
分析:金属钠与水的反应化学方程式为2Na+2H
2O═2NaOH+H
2↑,根据方程式可判断出生成的气体为氢气,根据生成氢气的物质的量计算气体中各种粒子的物质的量.
解答:解:9.2gNa的物质的量为n(Na)=
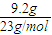
=0.4mol,反应的化学方程式为2Na+2H
2O═2NaOH+H
2↑,由方程式可知生成氢气的物质的量为n(H
2)=0.2mol,
A、H原子中无中子,故A错误;
B、1个H原子中含有1个电子,所以0.2molH
2中含有0.4mol电子,故B正确;
C、1个H原子中含有1个质子,所以0.2molH
2中含有0.4mol质子,故C错误;
D、0.2molH
2中含有0.2mol分子,故D错误.
故选B.
点评:本题考查化学方程式的有关计算,题目难度不大,本题注意H原子的结构特点.

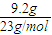 =0.4mol,反应的化学方程式为2Na+2H2O═2NaOH+H2↑,由方程式可知生成氢气的物质的量为n(H2)=0.2mol,
=0.4mol,反应的化学方程式为2Na+2H2O═2NaOH+H2↑,由方程式可知生成氢气的物质的量为n(H2)=0.2mol,

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案