
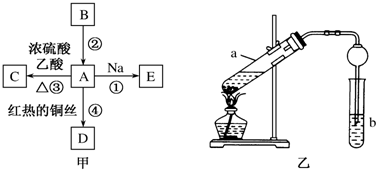
 A是石油裂解主要产物之一,其产量常用于衡量一个石油化工发展水平的标志.
A是石油裂解主要产物之一,其产量常用于衡量一个石油化工发展水平的标志.分析 (1)A是石油裂解主要产物之一,其产量常用于衡量一个石油化工发展水平的标志,可知A为CH2=CH2,结合转化A$\stackrel{①}{→}$CH3CH2OH$\stackrel{②}{→}$CH3CHO可知,①为乙烯与水的加成反应,②为乙醇的催化氧化反应;
(2)①乙酸中官能团为-COOH;
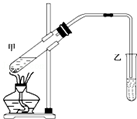
②甲中乙酸、乙醇发生酯化反应生成乙酸乙酯和水;
③饱和碳酸钠可吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度;
④加入碎瓷片,可防止液体剧烈沸腾;
⑤乙酸乙酯与碳酸钠溶液分层,乙酸乙酯的密度比水的密度小.
解答 解:(1)A是石油裂解主要产物之一,其产量常用于衡量一个石油化工发展水平的标志,可知A为CH2=CH2,结合转化A$\stackrel{①}{→}$CH3CH2OH$\stackrel{②}{→}$CH3CHO可知,①为乙烯与水的加成反应,②为乙醇的催化氧化反应,
反应①为CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,
反应②为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(2)①乙酸分子中官能团的名称是羧基,故答案为:羧基;
②甲中反应的化学方程式为CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;
③饱和碳酸钠的作用为吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度,故答案为:除去乙酸;
④实验时需要向反应试管中加入碎瓷片,目的是防暴沸,故答案为:防暴沸;
⑤制得的乙酸乙酯在试管乙中饱和Na2CO3溶液的上层,故答案为:上.
点评 本题考查有机物的推断及制备实验,为高频考点,把握有机物的官能团与性质、制备实验装置及技能为解答的关键,侧重分析与实验能力的考查,注意混合物分离及有机物性质的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用激光笔检验豆浆的丁达尔现象 | |
| B. | 胶体的分散质粒子直径小于l00nm但大于1nm,能通过滤纸,不能透过半透膜 | |
| C. | 存在自由移动的离子是电解质溶液导电的原因 | |
| D. | 用萃取的方法分离汽油和煤油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 第一次 | 第二次 | 第三次 | |
| 体积(mL) | 16.10mL | 16.60mL | 15.90mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
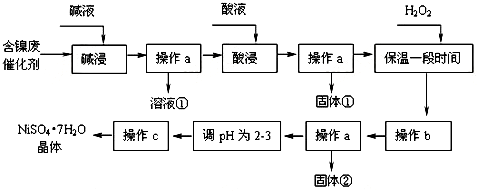
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀pH | 3.4 | 1.8 | 7.5 | 7.2 |
| 完全沉淀pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取100mL5mol/LH2SO4,加入400mL水 | |
| B. | 取200mL5mol/LHCl,加水稀释至500mL | |
| C. | 取200 mL5mol/LH2SO4,加水稀释至500mL | |
| D. | 取100 mL5mol/LHNO3,加水稀释至500mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱(Na2CO3)从物质的分类看不属于碱 | |
| B. | 由一种元素组成的物质一定是单质 | |
| C. | 凡是能电离出H+的化合物均属于酸 | |
| D. | 盐类物质一定含有金属离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | 5个 | B. | 4个 | C. | 3个 | D. | 2个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com