
| A. | 只有⑥ | B. | ④⑤⑥ | C. | ①③⑤ | D. | 全部 |
科目:高中化学 来源: 题型:选择题
| A. | -183 kJ•mol-1 | B. | +183 kJ•mol-1 | C. | -862 kJ•mol-1 | D. | +862 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
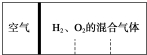 计算后填空:
计算后填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mLlmol/L氯化钾 | B. | 150mL3mol/L氯化钾 | ||
| C. | 75mL2mol/L氯化钙 | D. | 150mL1mol/L氯化铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56 g CO和32 g O2所具有的总能量小于88 g CO2所具有的总能量 | |
| B. | 碳的燃烧热是△H3 | |
| C. | △H1<△H3 | |
| D. | 28 g CO的总能量比44 g CO2的总能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(1s) | C. | E(4f)<E(4s)<E(3d) | D. | E(5s)>E(4s)>E(4f) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
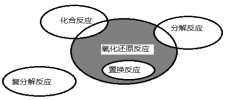 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )| A. | CuSO4+Mg=Cu+MgSO4 | B. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | ||
| C. | 2Na2O2+2CO2═2Na2CO3+O2 | D. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com