
 为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应: ,是导致汽车尾气中含有NO的原因之一。
,是导致汽车尾气中含有NO的原因之一。
①在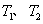 温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应
温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应 __________0(填“>”或“<”)。
__________0(填“>”或“<”)。
②在 温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率
温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率 ___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
 (2)利用右图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
(2)利用右图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有 生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L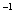 的醋酸与b mol
的醋酸与b mol L
L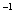
 溶液等体积混合,充分反应后,溶液中存在
溶液等体积混合,充分反应后,溶液中存在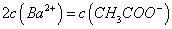 ,则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
,则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
下列说法中正确的是( )
A. 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
B. H2SO4与Ba(OH)2反应生成1mol水时放出的热叫做中和热
C. 热化学方程式中的化学计量数表示物质的量,可以是分数
D. 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是
A.[Na+]=[CH3COO-]+[CH3COOH] B.[H+]=[CH3COO-]+[OH-]
C.[Na+]>[CH3COO-]>[OH-]>[H+] D.[CH3COO-]>[Na+]>[H+]>[OH-]
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列化合物:①NaOH, ②H2SO4,③CH3COOH, ④NaCl, ⑤CH3COONa, ⑥NH4Cl,⑦CH3COONH4, ⑧NH4HSO4, ⑨NH3•H2O,
请回答下列问题:
(1)NH4Cl溶液中离子浓度大小顺序为 ;
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)= ;
在pH=3的CH3COOH 溶液中,水电离出来的c(H+)= ;
(3)已知水存在如下平衡:H2O+ H2O H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是 。
H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是 。
A. 向水中加入NaHSO4固体 B. 向水中加NaHCO3固体
C. 加热至100℃[其中c(H+) = 1×10-6 mol•L-1] D. 向水中加入NH4Cl固体
(4)若浓度均为0.1 mol·L-1、等体积的NaOH和NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则 m n (填 “<”、“>”或“=”)。
(5)物质的量浓度相同的①、②、③、④、⑤、⑥六种稀溶液,按pH由大到小的顺序为(填序号)____________________________________________________。
(6) 物质的量浓度相同的⑥、⑦、⑧、⑨四种稀溶液中,NH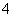 浓度由大到小的顺序是(填
浓度由大到小的顺序是(填
序号)________ 。
(7)已知t℃时,Kw=1×10-12,在该温度时将pH=9的NaOH溶液a L与pH=2的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a:b=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的描述正确的是
A.用湿润的pH试纸测定溶液的pH,测定结果偏小,该溶液一定呈酸性
B.中和滴定实验中,锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,须干燥 或用待装液润洗后方可使用
C.将碘水倒入分液漏斗,加入适量乙醇,振荡后静置,能将碘萃取到乙醇中
D.向含有FeCl2杂质的FeCl3溶液中通入足量C12后,充分加热蒸干,可得到纯净的FeCl3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
元素的性质随着元素原子序数的递增而呈周期性变化的原因是
A.元素原子的核外电子排布呈周期性变化
B.元素的原子半径呈周期性变化 C.元素的化合价呈周期性变化
D.元素的金属性、非金属性呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
按下列要求回答:现有: ①BaCl2;②冰;③NH4Cl;④Na2SO4;⑤干冰;⑥碘片 六种物质。
(1) 属于离子化合物的是__________(填序号,下同),物质中只有离子键的物质有________,
属于共价化合物的是________。
(2) 熔化时不需要破坏化学键的是__________,熔点最低的是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com