


科目:高中化学 来源: 题型:
| A、小苏打、氢氧化铝可以治疗胃酸过多症 |
| B、淡黄色粉末Na2O2可用于“蛟龙号”的供氧剂 |
| C、造成大气污染的“PM2.5”是气溶胶 |
| D、明矾净水的原理是Al3+水解生成的Al(OH)3胶体有强的吸附性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氯仿(CHCl3)常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2→2HCl+2COCl2.下列说法不正确的有( )
氯仿(CHCl3)常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2→2HCl+2COCl2.下列说法不正确的有( )| A、CHCl3分子的空间构型为正四面体 |
| B、COCl2分子中中心C原子采用sp2杂化 |
| C、COCl2分子中所有原子的最外层电子都满足8电子稳定结构 |
| D、使用前可用硝酸银稀溶液检验氯仿是否变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| c(H2)?c(CO) |
| c(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
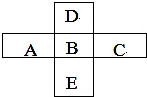 A、B、C、D、E五种主族元素所处周期表的位置如图所示.
A、B、C、D、E五种主族元素所处周期表的位置如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com