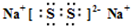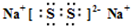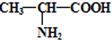甲、乙、丙、丁、戊都是单质,其中甲、乙、丙是常见金属,丁和戊是气体,且丁呈黄绿色.A~K是化合物.F是红褐色沉淀,G是淡黄色固体粉末,K是丁的气态氢化物.已知乙和丙在周期表中位于同一周期,且丙原子最外能层电子构型为ns
1.它们之间有如图1的转化关系(部分反应物或产物省略).
回答以下问题:
(1)G的电子式:
,深蓝色溶液中溶质的化学式:
[Cu(NH3)4]Cl2
[Cu(NH3)4]Cl2
.
(2)甲与同周期的金属元素相比,第一电离能由小到大的顺序是
Na<Al<Mg
Na<Al<Mg
(用元素符号表示).
(3)完成反应方程式
反应①中,E和G的物质的量之比为2:1:
3Na2O2+6FeCl2+6H2O=4Fe(OH)3+2FeCl3+6NaCl
3Na2O2+6FeCl2+6H2O=4Fe(OH)3+2FeCl3+6NaCl
;
反应②的离子方程式:
3AlO2-+Al3++6H2O=4Al(OH)3↓
3AlO2-+Al3++6H2O=4Al(OH)3↓
.
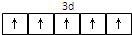
(4)乙的高价阳离子的最高能级电子排布图为:
.检验该离子常用KSCN溶液.乙的高价阳离子与SCN
-可形成配位数不同的多种配合物.在含0.01molC的溶液中,加入100mL0.34mol?L
-1的KSCN溶液,所得配合物是下列中的
③④
③④
(选填序号),其物质的量之比为
3:2
3:2
.
①[Fe(SCN)]
2+;②[Fe(SCN)
2]
+;③Fe(SCN)
3;④[Fe(SCN)
4]
-;⑤[Fe(SCN)
5]
2-;⑥[Fe(SCN)
6]
3-(5)丙的基态原子电子排布式为
1s22s22p63s23p63d104s1或[Ar]3d104s1
1s22s22p63s23p63d104s1或[Ar]3d104s1
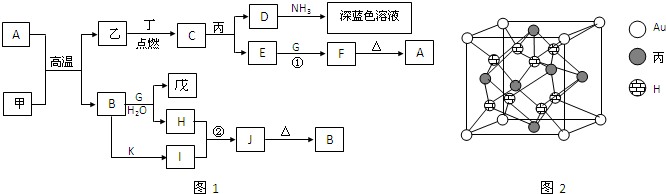
.丙与金形成的一种合金晶体具有立方最密堆积的结构,这种晶体具有储氢功能,氢原子可进入到由丙原子与Au原子构成的四面体空隙中.其晶胞结构如图2所示.这种合金晶体储氢后的化学式应为
AuCu3H8
AuCu3H8
.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案