
【题目】(8分)工业上可用以下方案使饮用水中NO3- 含量达标。
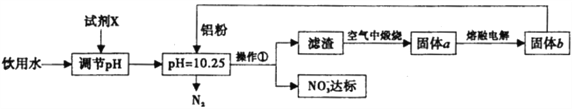
请回答下列问题:
(1)调节pH不宜过大或过小,否则会造成__________的利用率降低;试剂X可选用 ________(填序号)
.A.NaOH B.Ca(OH)2 C.NH3·H2O D. CO2
(2)写出溶液中铝粉和NO3-反应的离子方程式:_________________________。
(3)还可用以下化学反应使饮用水中NO3-含量达标,产物之一是空气的主要成分。完成下列离子方程式:![]() H2+
H2+ ![]() NO3-+
NO3-+![]() ________
________![]()
![]() _______+
_______+![]() H2O
H2O
【答案】 铝粉 B 10Al+6NO3-+18H2O==10A1(OH)3↓+3N2↑+6OH- 5H2+2NO3-+2H+![]() N2+6H2O
N2+6H2O
【解析】(1)pH过大,铝和碱反应产生氢气,pH过小,NO3-在酸性条件下具有强氧化性,产生NOx,而不是氮气,因此造成铝的利用率降低;试剂X为Ca(OH)2,来源丰富,价格便宜,且Ca2+对人体无害,故选项B正确;(2)根据流程,Al转变成Al(OH)3,NO3-转变成N2,根据化合价的升降法,进行配平,因此离子反应方程式为:10Al+6NO3-+18H2O=Al(OH)3↓+3N2↑+6OH-;(3)产物是空气主要成分,则NO3-转变成N2,根据化合价的升降法进行配平,其离子反应方程式为:5H2+2NO3-+2H+![]() N2+6H2O。
N2+6H2O。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.铜、石墨均导电,所以它们均是电解质
B.NH3、CO2的水溶液均导电,所以NH3、CO2均是电解质
C.液态HC1、固体NaCl均不导电,所以HC1、NaCl均是非电解质
D.蔗糖、酒精在水溶液或熔融状态下均不导电,所以它们均是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
在实验室中模拟工业制取NaHCO3的实验步骤如下:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:分离C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。
(1)下图所示装置的连接顺序是:a接________;________接_______;b接_________(填接口编号)。

(2)A中常选用的固体反应物为_______________;D中应选用的液体为________________。
(3)第二步中让___________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是______________________;装有无水CaCl2的U形管的作用是_________________________。
(5)第三步分离出NaHCO3固体的操作是________________。
(6)第四步中所加固体粉末化学式为 。所得的晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4C1。简要写出操作和现象_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体和其他分散系(溶液、浊液)的本质区别是( )
A.分散质粒子的大小 B.是不是一种稳定的体系
C.会不会产生丁达尔现象 D.粒子有没有带电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】16O和18O是氧元素的两种核素,用NA表示阿伏加德罗常数的数值,下列说法不正确的是( )
A.在18 g 16O2中含有NA个氧原子
B.16O与18O核外电子排布方式相同
C.在标准状况下,1.12 L 16O2和1.12 L 18O2均含有0.1NA个氧原子
D.18O2和16O2化学性质几乎相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活, 雾霾的形成与汽车排放的 NOx等有毒气体有关。
(1)可以通过活性炭处理汽车尾气,原理为:C(s)+2NO(g)![]() N2(g)+CO2 (g) H<0。
N2(g)+CO2 (g) H<0。
①下列情况能说明该反应达到平衡状态的是( )
A.2ν正(NO) =ν逆(CO2)
B.在恒温、恒容的容器中,混合气体的压强保持不变
C.在绝热、恒容的容器中,反应的平衡常数不再变化
D.在恒温、恒压的容器中, 混合气体的密度保持不变
②在恒温、恒容条件下, 加入2 mol C(s)和2 mol NO(g)达平衡后,再在绝热、恒容条件下,加入1 mol NO重新达平衡后, N2的百分含量将____________(填“增大”、“减小”、“不变”)。
(2)臭氧是理想的烟气脱硝试剂,原理为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g)。若在容积为10L的密闭容器中进行该反应,起始时充入0.4 molNO2、0.2 molO3,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
N2O5(g)+O2(g)。若在容积为10L的密闭容器中进行该反应,起始时充入0.4 molNO2、0.2 molO3,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。

①实验a从开始至平衡时的反应速率v(O3)=_________;实验c中NO2的平衡转化率为___________。
②与实验a相比,其他两组改变的实验条件分别是:b_________,c__________。
③M点的逆反应速率 v(逆)____________N点的正反应速率v(正)(填“>”、“<”或“=”)。
④若在N点时,维持温度和压强不变,t1时再加入0.4 molNO2、0.2 mol O3,请在图中画出逆反应速率在t1后随时间t的变化曲线图。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有德国重离子研宄中心人工合成的第112号元素的正式名称为“Copemicium”,相应的元素符号位“Cn”,该元素的名称是为了纪念天文学家哥白尼而得名。该中心人工合成Cn的过程可表示为:
![]() 。下列叙述中正确的是
。下列叙述中正确的是
A. 上述合成过程中属于化学变化
B. Cn元素的相对原子质量为277
C. ![]() 的原子核内中子数比质子数多53
的原子核内中子数比质子数多53
D. Cn元素位于元素周期表的第六周期,是副族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:4CO(g)+2NO2(g)= 4CO2(g)+N2(g) △H=-1200 kJ· mol-1,温度不同 (T2>T1)其他条件相同时,下列图像正确的是( )

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com