
���� ��1��������Ӧ�и�Ԫ�ػ��ϼ۱仯������������ԭ��Ӧ��ʧ�����غ���ɽ��ԭ�Ӹ����غ������д����ʽ�������ת����Ŀ��������ԭ��Ӧ������Ԫ�ػ��ϼ����ߵķ�Ӧ��Ϊ��ԭ����
��2���������ͻ�ԭ����Ӧ������������ͻ�ԭ��������������Դ�����������������ԣ��Դ˷�����
��� �⣺��1�����������֪����������ǿ�������ԣ��ܹ����ⵥ���������ɵ�����Ȼ��⣬��Ӧ��һ���������Ӳμӷ�Ӧ��2�����ӣ�һ������Ӳμӷ�Ӧʧȥ10�����ӣ��÷�Ӧ�е�ʧ���ӵ���С��������10�����Է���ʽΪI2+5Cl2+6H2O=2HIO3+10HCl����Ӧ�еⵥ�ʻ��ϼ����ߣ�Ϊ��ԭ�������ݷ���ʽ��֪������2mol����ת��10mol���ӣ�����0.1mol HIO3����ʱ����Ӧת�Ƶĵ�����ĿΪ��0.5NA��
�ʴ�Ϊ��1��5��6H2O��2��10��I2��0.5NA��
��2�������������Ա���ǿ����KI����KBr��������Br2����CCl4���Ϊ��ɫ�������μ���ˮ��CCl4�����ɫû�б仯��˵��������HBrO3��Cl2�������������ͻ�ԭ����Ӧ������������ͻ�ԭ��������������Դ�����������������ԣ�
����Cl2��HIO3������������˳��ΪHBrO3��Cl2��HIO3��
�ʴ�Ϊ��HBrO3��Cl2��HIO3��
���� ���⿼�������������Լ������Ե�ǿ���Ƚϣ���ȷ������ԭ��Ӧ�����ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 �±�Сѧ��Ԫ�Բ���ϵ�д�
�±�Сѧ��Ԫ�Բ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢۢ� | B�� | �ܢݢ� | C�� | �ڢۢ� | D�� | �٢ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
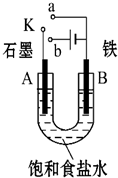 ij����С������ͼװ�ý���ʵ�飬�Իش��������⣮
ij����С������ͼװ�ý���ʵ�飬�Իش��������⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
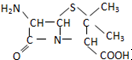 �� ����ù������ص�ĸ�ˣ����л���F�������ɰ�Ī���֣�ijͬѧ�öԼ�����Ϊԭ����ư�Ī���ֵĺϳ�·����ͼ��
�� ����ù������ص�ĸ�ˣ����л���F�������ɰ�Ī���֣�ijͬѧ�öԼ�����Ϊԭ����ư�Ī���ֵĺϳ�·����ͼ��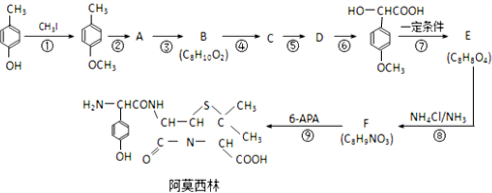
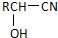 $\stackrel{H_{2}O/H+}{��}$
$\stackrel{H_{2}O/H+}{��}$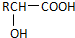
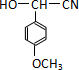 ��
��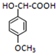 ��һ��ͬ���칹���һ�ȴ���ĽṹΪ
��һ��ͬ���칹���һ�ȴ���ĽṹΪ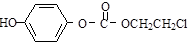 ����������NaOHˮ��Һ�м��ȷ�Ӧ��Ӧʱ�Ļ�ѧ����ʽΪ
����������NaOHˮ��Һ�м��ȷ�Ӧ��Ӧʱ�Ļ�ѧ����ʽΪ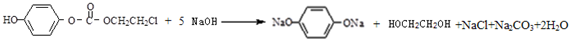 ��
��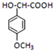 ��������������ͬ���칹����3�֣�
��������������ͬ���칹����3�֣��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 500 mL1 mol/L MgCl2��Һ�к���Cl-��ĿΪ0.5NA | |
| B�� | ��״���£�33.6L SO3��48gO2��ռ�������� | |
| C�� | 17 gNH3���еĵ��Ӹ���Ϊl0NA | |
| D�� | 1 mol O2��2 mol SO2һ�������»�Ϸ�Ӧ��������2 mol SO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
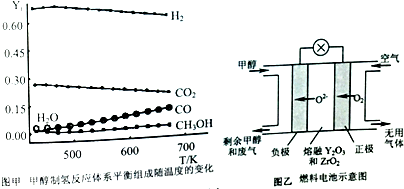
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
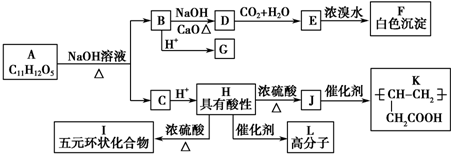
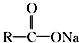 +NaOH$��_{��}^{CaO}$R�TH+Na2CO3
+NaOH$��_{��}^{CaO}$R�TH+Na2CO3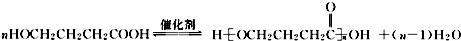 ��
�� ��
��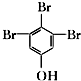 ��д�ṹ��ʽ����
��д�ṹ��ʽ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ���� | B�� | NaOH��Һ | C�� | Ca��OH��2��Һ | D�� | CaCl2��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com