
已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、硫酸。按要求回答下列问题:
(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因________________________________________________________________________。
(2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池?________。若能,请写出电极反应式,负极:____________________,正极:________________________。(若不能,后两空不填)
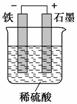
(3)设计一种以铁和稀硫酸反应为原理的原电池,要求画出装置图(需标明电极材料及电池的正、负极)。
答案 (1)二者连接在一起时,接头处在潮湿的空气中形成原电池而被腐蚀
(2)能 Cu—→Cu2++2e- 2Fe3++2e-—→2Fe2+
(3)
解析 (1)当Cu、Al导线连接时,接触到潮湿的空气就易形成原电池而被腐蚀。
(2)因为FeCl3能与Cu发生反应:2FeCl3+Cu===2FeCl2+CuCl2,因此根据给出的条件可以设计成原电池,其负极为Cu,反应为Cu—→Cu2++2e-,正极为石墨,电极反应式为2Fe3++2e-—→2Fe2+。
(3)因为总反应式为Fe+H2SO4===FeSO4+H2↑,所以负极为Fe,正极可为Cu、Ag或石墨,电解质为稀硫酸,即可画出装置图。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
根据下图的转化关系判断下列说法正确的是(反应条件已略去)
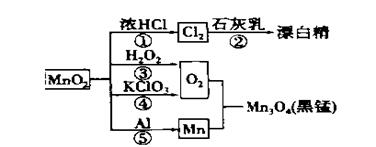
A. 反应①②③④⑤均属于氧化还原反应和离子反应
B. 反应⑤说明该条件下铝可用于制熔点较高的金属
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1
D. 反应①中氧化剂与还原剂的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
已知葡萄糖的燃烧热是ΔH=-2 840 kJ·mol-1,当它氧化生成1 g液态水时放出的热
量是( )
A.26.3 kJ B.51.9 kJ C.155.8 kJ D.467.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
在25°C、100 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+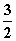 O2(g)===CO2(g)+2H2O(l) ΔH=725.8 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=725.8 kJ·mol-1
B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-725.8 kJ·mol-1
D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=1 452 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
以锌片和铜片为两极,以稀硫酸为电解质溶液组成原电池,当导线中通过2 mol电子时,下列说法正确的是( )
A.锌片溶解了1 mol,铜片上析出1 mol H2
B.两极上溶解和析出的物质质量相等
C.锌片溶解31 g,铜片上析出1 g H2
D.锌片溶解了1 mol,硫酸消耗0.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.放热反应在常温下一定容易进行
B.植物的光合作用是把太阳能转化为热能的过程
C.反应是放热还是吸热是由反应物和生成物所具有的能量的相对大小决定的
D.凡是在加热或点燃条件下进行的反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。
电解法:
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(1)用Fe做电极的原因为_____________________________________________。
(2)在阴极附近溶液pH升高的原因是 (用电极反应解释) __________________。
溶液中同时生成的沉淀还有___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)现有0.1 mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是_______________________________________________________;
纯碱溶液呈碱性的原因是(用离子方程式表示)___________________________。
(2)为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案:
__________________________________________________________________。
(3)为证明盐的水解是吸热反应,四位学生分别设计了如下方案,其中正确的是
_____________。
A.甲学生:在醋酸钠溶液中滴入2滴酚酞溶液,加热后红色加深,说明盐类水解是吸热反应
B.乙学生:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热反应
C.丙学生:将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应
D.丁学生:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应
B项中和反应本身是放热反应,C项是因为NH4NO3溶于水吸热,D项是因为NH4Cl抑制NH3·H2O 的电离而使pH变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com