
| 选项 | a | b | c | d |
| A | Pt | Pt | NaOH | NaOH |
| B | C | C | NaCl | NaOH |
| C | Cu | Cu | CuSO4 | Cu(OH)2 |
| D | Pt | Pt | H2SO4 | H2O |
科目:高中化学 来源:不详 题型:单选题
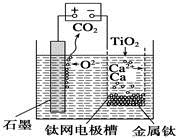
| A.由TiO2制得1 mol金属Ti,理论上外电路转移2 mol电子 |
| B.阳极的电极反应式为C+2O2--4e-=CO2↑ |
| C.在制备金属钛前后,整套装置中CaO的总量减少 |
| D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④ | B.②③⑤ |
| C.③④ | D.①③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
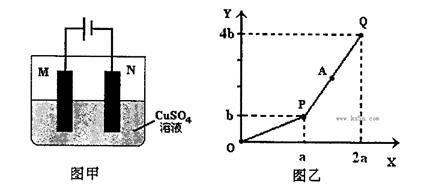
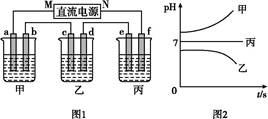
| A.电解过程中N电极表面先有红色物质生成,后有气泡产生 |
| B.A点所得溶液只需加入一定量的CuO固体就可恢复到起始状态 |
| C.Q点时M、N两电极上产生的气体在相同条件下体积相同 |
| D.若M电极材料换成Cu做电极,则电解过程中CuSO4溶液的浓度不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题



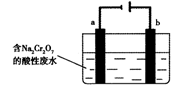
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.滴有酚酞的NaOH溶液 | B.酸性KMnO4 |
| C.滴有淀粉的碘水 | D.BaCl2溶液. |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | S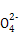 、OH- 、OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
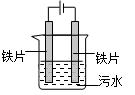
| A.可以用铝片或铜片代替铁片 |
| B.阳极产生的气体可能是O2 |
| C.电解过程中H+向阳极移动 |
| D.若污水导电能力较弱,可加入足量硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com