
室温下,下列各组离子在指定溶液中能大量共存的是( )
A.饱和氯水中:Cl-、NO 、Na+、SO
、Na+、SO
B.c(H+)=1.0×10-13mol/L溶液中:CO 、K+、SO
、K+、SO 、Br-
、Br-
C.Na2S溶液中:SO 、K+、Cl-、Cu2+
、K+、Cl-、Cu2+
D.pH=12的溶液中:NO 、I-、Na+、Al3+
、I-、Na+、Al3+
科目:高中化学 来源: 题型:
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单阳离子是________。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是__________________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是______________________________。
(4)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)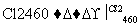 SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯)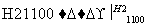 Si(纯)
Si(纯)
写出SiCl4的电子式:________________;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是________。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是
A.治理“地沟油”,可通过水解反应制得肥皂
B.硅晶体具有半导体性能,可用于制取光导纤维
C.人类超量碳排放及氮氧化物和二氧化硫的排放是形成酸雨的主要原因
D.PM2.5是指空气中直径≤ 2.5 μm的颗粒物,直径为2.5 μm的颗粒物分散在空气中形成胶体(1μm = 10 -6 m)
查看答案和解析>>
科目:高中化学 来源: 题型:
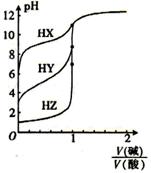
常温下,浓度均为0.1000mol/L的三种一元酸HX、HY、HZ溶液,分别用0.1000mol/L的NaOH溶液进行滴定,滴定曲线如图所示。下列有关叙述正确的是
A.NaOH溶液与三种酸的反应均是吸热反应
B.酸性强弱:HX>HY>HZ
C.滴定酸HY可用酚酞作指示剂
D.滴定三种酸都可用甲基橙作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,可用 离子方程式H++OH-===H2O表示的是( )
离子方程式H++OH-===H2O表示的是( )
A.NH4Cl+NaOH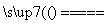 NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
B.Mg(OH)2+2HCl===MgCl2+2H2O
C.NaOH+NaHCO3===Na2CO3+H2O
D.NaOH+HNO3===NaNO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
在下述条件下,一定能大量共存的离子组是( )
A.无色透明的水溶液中:K+、Ba2+、I-、MnO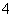
B.含有大量NO 的水溶液中:NH
的水溶液中:NH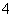 、Fe2+、SO
、Fe2+、SO 、H+
、H+
C.c(HCO )=0.1 mol/L的溶液中:Na+、K+、CO
)=0.1 mol/L的溶液中:Na+、K+、CO 、Br-
、Br-
D.强碱性溶液中:ClO-、S2-、HSO 、Na+
、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有SO 、SO
、SO 、HCO
、HCO 三种离子中的两种或三种。为探究其组成,小明取出两份相同的样品溶液于试管中,向一份中加入过量的盐酸,产生无色气泡;向另一份中滴加过量的氯化钡溶液,产生白色沉淀。请设计合理实验,做进一步的探究,对小明的实验给出结论。仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、集气瓶、铁架台、漏斗、滤纸、酒精灯、带单孔胶塞的导管;1 mol/L硫酸;2 mol/L盐酸;2 mol/L硝酸;1 mol/L氯化钡、澄清石灰水、品红溶液、蒸馏水。
三种离子中的两种或三种。为探究其组成,小明取出两份相同的样品溶液于试管中,向一份中加入过量的盐酸,产生无色气泡;向另一份中滴加过量的氯化钡溶液,产生白色沉淀。请设计合理实验,做进一步的探究,对小明的实验给出结论。仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、集气瓶、铁架台、漏斗、滤纸、酒精灯、带单孔胶塞的导管;1 mol/L硫酸;2 mol/L盐酸;2 mol/L硝酸;1 mol/L氯化钡、澄清石灰水、品红溶液、蒸馏水。
完成下列探究过程:
(1)提出假设:
假设1:溶液中存在SO 、SO
、SO ;
;
假设2:__________________________________________________________________;
假设3:__________________________________________________________________;
假设4:溶液中存在SO 、SO
、SO 、HCO
、HCO 。
。
(2)基于假设4,设计出实验方案,将实验操作、预期的实验现象和结论填在下表中。
[提示]Ⅰ.按照下表的方式作答,注意前后内 容的对应。
容的对应。
Ⅱ.注意文字简洁。
Ⅲ.可不填满,也可增加步骤。
| 步骤编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② | ||
| ③ | ||
| ④ | ||
| …… | …… | …… |
查看答案和解析>>
科目:高中化学 来源: 题型:
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。
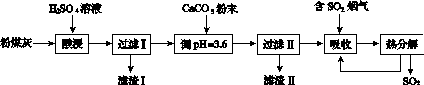
(1)酸浸时反应的化学方程式为____________________;滤渣Ⅰ的主要成分为________(填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为________(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低,其原因是__________________________(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是________________________;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
维生素A是复杂机体必需的一种营养素,也是最早被发现的一种维生素,如果儿童缺乏维生素A时,会出现夜盲症,并可导致全身上皮组织角质变性等病变。已知维生素A的结构简式如下,关于它的正确说法是( )
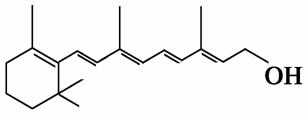
A.维生素A分子式为C20H32O
B.维生素A是一种极易溶于水的醇
C.维生素A在铜作催化剂加热的条件下可以发生催化氧化反应生成一种醛
D.1 mol 维生素A最多可以和6 mol氢气加成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com