
1.52g铜镁合金完全溶解于50mL密
度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。
(1)该合金中铜与镁的物质的量之比是 。
(2)NO2和N2O4的混合气体中,NO2的体积分数是 。
(3)得到2.54 g沉淀时,加入NaOH溶液的体积是 mL
【知识点】本题考查化学方程式的有关计算;有关混合物反应的计算
【答案解析】(1)2:1
(2)80℅
(3)640mL
解析:(1).金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为2.54g-1.52g=1.02g,氢氧根的物质的量为1.02g/17g/mol=0.06mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:2x+2y=0.06 ,64x+24y=1.52,解得x=0.02,y=0.01,故合金中铜与镁的物质的量之比是0.02mol:0.01mol=2:1。(2).NO2和N2O4混合气体的物质的量为: 1.12L÷22.4L/mol=0.05mol,令二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.05-a)mol,根据电子转移守恒可知,a×1+(0.05-a)×2×1=0.06,解得a=0.04,NO2的体积分数是80℅.(3)反应后溶质为硝酸钠,根据氮元素守恒可知,硝酸钠的物质的量为0.05L×14mol/L-0.04mol-(0.05-0.04)×2=0.64mol,根据钠离子守恒可知n(NaOH)=n(NaNO3)=0.64mol,故需要氢氧化钠溶液的体积为0.64mol÷1mol/L=0.64L=640mL,
【思路点拨】本题考查混合物的有关计算,难度中等,理解反应发生的过程是关键,是对学生综合能力的考查,注意根据守恒思想进行的解答


科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.三氯化铁溶液中加入铁:Fe3++Fe===2Fe2+
B.氯化镁溶液中加入硝酸银溶液:Ag++Cl-===AgCl↓
C.过量氯气通入氯化亚铁溶液中:Fe2++Cl2===Fe3++2Cl-
D.氢氧化铜溶于稀硫酸中:OH-+H+===H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法一定正确的是 ( )
A.常温下,1 L 0.1 mol/L的NH4NO3溶液中氧原子数为0.3NA
B.1 mol的羟基与1 mol的氢氧根离子所含电子数均为10NA
C.常温、常压下,4.6 g NO2和N2O4混合气体中含有的O原子数目为0.2NA
D.Fe与水蒸气在高温条件下反应,有1 mol Fe参与反应,则转移电子的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于氯的说法正确的是
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.若1735Cl、1737Cl为不同的核素,有不同的化学性质
C.实验室制备Cl2,可用排饱和食盐水法收集
D.1.12 LCl2含有1.7NA个质子(NA 表示阿伏伽德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
两种大气污染物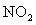 和
和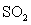 在一定条件下可发生如下反
在一定条件下可发生如下反
应:NO2 + SO2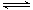 NO + SO3,在体积为VL的密闭容器中通入
NO + SO3,在体积为VL的密闭容器中通入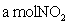 和
和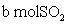 ,反应后容器内硫原子和氧原子的个数比为( )
,反应后容器内硫原子和氧原子的个数比为( )
A.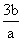 B.
B.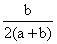 C.
C.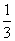 D.
D.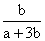
查看答案和解析>>
科目:高中化学 来源: 题型:
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ:反应产物的定性探究。
实验装置如图所示:(固定装置已略去)

(1)A中反应的化学方程式为 。
(2)F烧杯中的溶液通常是 。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
实验Ⅱ:反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
| 硫酸/mol·L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
资料2:X-射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。仅由上述资料可得出的正确结论是 __。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15 mol/L
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol/L Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为 _。(已知:2Cu2++4I-===2CuI+I2,2S2O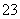 +I2===S4O
+I2===S4O +2I-)
+2I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的铁、氧化铁、氧化铜的混
合物粉末放入100mL 4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28g。过滤,滤液中无Cu2+。将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L。则原混合物中单质铁的质量是
A.2.24g B.3.36g C.5.60g D.10.08g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分类或归类正确的是
①液氯、氨水、干冰、碘化银均为纯净物
②CaCl2、NaOH、HCl、IBr均为化合物
③明矾、水银、烧碱、硫酸均为强电解质
④C60、C70、金刚石、石墨均为碳的同素异形体
⑤碘酒、淀粉、水雾、纳米材料均为胶体
A.①③④ B.②③ C.②④ D.②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com