
分析 (1)离子反应是由离子参加的反应,化合物在一定的条件下电离出能反应的离子;
(2)置换反应都是氧化还原反应,离子反应部分是氧化还原反应,部分是非氧化还原反应,置换反应部分是离子反应,部分不是离子反应;
(3)氧化还原反应中,化合价升高值=化合价降低值=转移电子数,根据化合价变化确定电子转移情况;
(4)反应中,高锰酸根离子中锰元素化合价从+7价降为+2价,Fe元素+2价升高到+3价,依据方程式判断转移电子数目,用单线桥表示;
(5)Fe元素的化合价升高;维生素C能把铁离子还原为亚铁离子.
解答 解:(1)离子反应是由离子参加的反应,发生的条件是化合物在一定的条件下必须电离出能反应的离子,
故答案为:③⑤;
(2)置换反应都是氧化还原反应,离子反应部分是氧化还原反应,部分是非氧化还原反应,置换反应部分是离子反应,部分不是离子反应,其关系如图所示: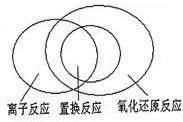 ,
,
故答案为: ;
;
(3)氧化还原反应KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O中,化合价升高值=化合价降低值=转移电子数=5,电子转移情况如下: ,
,
故答案为: ;
;
(4)反应中,高锰酸根离子中锰元素化合价从+7价降为+2价,Fe元素+2价升高到+3价,反应中转移电子数目为5,则用单线桥法标出电子转移数目和方向为: ;
;
故答案为: ;
;
(5)Fe元素的化合价升高,所以变色的过程中的Fe2+被氧化;维生素C能把铁离子还原为亚铁离子,则铁离子作氧化剂,维生素C作还原性,具有还原性;
故答案为:氧化;B.
点评 本题考查了氧化还原反应方程、双线桥和单线桥表示方法的应用,准确判断氧化还原反应中元素化合价变化是解题关键,注意单线桥和双线桥表示的注意事项,题目难度不大.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.2 NA | |
| B. | l L 0.1mol•L-1的H2SO3溶液中含有H+的数目为0.2 NA | |
| C. | 7.8 g Na2O2中含有的阴离子数目为0.1 NA | |
| D. | 常温常压下,14 g乙烯和丙烯的混合气体中氢原子数为 2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
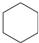 ,名称是环己烷.
,名称是环己烷.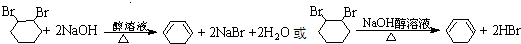 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | 2Mg+O2 $\frac{\underline{\;点燃\;}}{\;}$2MgO | ||
| C. | Na2CO3+2HCl═2NaCl+H2O+CO2↑ | D. | Cu(OH)2 $\frac{\underline{\;△\;}}{\;}$CuO+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
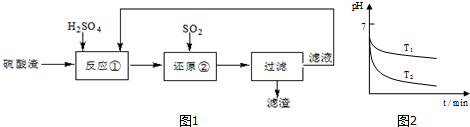
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仍平衡 | B. | 盛钠的一端下沉 | C. | 盛镁的一端下沉 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
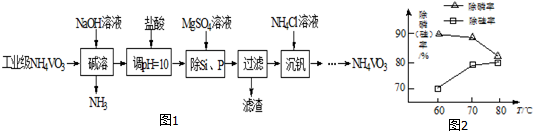
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com