
| A. | 1molCl2参加反应,不一定得到2NA个电子 | |
| B. | 标准状况下,将22.4LNO和11.2LO2混合后,可以得到NA个NO2分子 | |
| C. | 常沮常压下,1L0.1mol/LHF溶液中含有0.1NA个H+ | |
| D. | 25℃,1.7g羟基所含电子数为NA |
分析 A、氯气参加反应后的价态不明确;
B、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4;
C、HF为弱酸,在溶液中只能部分电离;
D、求出羟基的物质的量,然后根据-OH中含9个电子来分析.
解答 解:A、氯元素既有正价又有负价,而氯气参加反应后的价态不明确,故1mol氯气反应后不一定得电子,还可能失电子,故A正确;
B、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4,导致分子个数减少,故所得的NO2分子个数小于NA个,故B错误;
C、HF为弱酸,在溶液中只能部分电离,故溶液的氢离子个数小于0.1NA个,故C错误;
D、1.7g羟基的物质的量为0.1mol,而-OH中含9个电子,故0.1mol-OH中含0.9NA个电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:选择题
 如图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜.用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀.下列说法正确的是( )
如图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜.用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀.下列说法正确的是( )| A. | 甲中A处通入CH4,电极反应式为CH4+10OH--8e-═CO32-+7H2O | |
| B. | 乙中电解MgCl2溶液的总反应为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 理论上甲中每消耗22.4 L CH4(标准状况下),乙中产生4 mol Cl2 | |
| D. | 甲、乙中电解质溶液的pH都增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
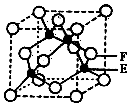 A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大.A的原子半径在周期表中最小,B原子核外电子有6种不同的运动状态.C元素原子的最外层电子数是次外层电子数的3倍.D元素第一电离能至第四电离能分别是I1=578kJ/mol、I2=1817kJ/mol、I3=2745kJ/mol、I4=11575kJ/mol.E与B可形成正四面体形分子.F的一种同位素的质量数为63,中子数为34.回答下列问题:
A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大.A的原子半径在周期表中最小,B原子核外电子有6种不同的运动状态.C元素原子的最外层电子数是次外层电子数的3倍.D元素第一电离能至第四电离能分别是I1=578kJ/mol、I2=1817kJ/mol、I3=2745kJ/mol、I4=11575kJ/mol.E与B可形成正四面体形分子.F的一种同位素的质量数为63,中子数为34.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
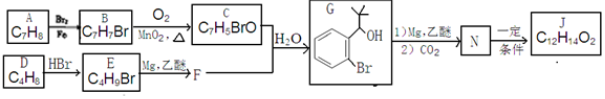

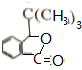 .
.
 反应①的反应条件和试剂分别为光照、Br2;L的结构简式为
反应①的反应条件和试剂分别为光照、Br2;L的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2在正极发生氧化反应 | |
| B. | 燃料电池的能量转化率可达100% | |
| C. | 工作一段时间后电解质溶液中OH-的物质的量浓度增大 | |
| D. | 产物为无污染的水,属于环境友好电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH4$→_{光照}^{Cl_{2}}$HCl$\stackrel{NH_{3}}{→}$NH4Cl | |
| B. | CH2═CH2$→_{催化剂,△}^{H_{2}O}$CH3CH2OH$→_{催化剂,△}^{O_{2}}$CH3CHO | |
| C. | 淀粉$→_{△}^{催化剂}$葡萄糖$→_{△}^{AgNO_{3}溶液}$银镜 | |
| D. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,将pH=4的CH3COOH溶液稀释后,溶液中所有离子的浓度均降低 | |
| B. | 温度一定时,向水中滴加少量酸或碱形成稀溶液,水的离子积常数Kw不变 | |
| C. | 3C(s)+CaO(s)=CaC2(s)+CO(g) 在常温下不能自发进行,说明该反应的△H>0 | |
| D. | C(s)+H2O(g)?CO(g)+H2(g)(△H>0),其他条件不变时,升高温度,正反应速率增大,逆反应速率减小,平衡正向移动. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com