
在一支试管中加入2~3mL溴水,再向其中加入1mL四氯化碳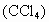 液体后振荡(四氯化碳的密度为
液体后振荡(四氯化碳的密度为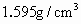 ,不溶于水)静置、溴水中的溴
,不溶于水)静置、溴水中的溴 被提取到了四氯化碳中,请说明该操作的实验原理、实验步骤以及实验现象.
被提取到了四氯化碳中,请说明该操作的实验原理、实验步骤以及实验现象.
|
(1) 实验原理①四氯化碳 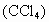 是一种有机化合物,它是一种不溶于水、密度比水大的无色液体,与水相混时,因互不溶解而分层,上层为水,下层为四氯化碳.四氯化碳是一种重要而又常用的有机溶剂,溴在水中溶解度很小,而在四氯化碳中溶解度很大,当把溴水与四氯化碳混合振荡后,溴就从水中转移到四氯化碳中. 是一种有机化合物,它是一种不溶于水、密度比水大的无色液体,与水相混时,因互不溶解而分层,上层为水,下层为四氯化碳.四氯化碳是一种重要而又常用的有机溶剂,溴在水中溶解度很小,而在四氯化碳中溶解度很大,当把溴水与四氯化碳混合振荡后,溴就从水中转移到四氯化碳中.
②用分液漏斗进行分液操作. (2) 实验步骤在两支试管中各加入 2~3mL溴水,向其中一支试管中滴加1mL四氯化碳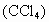 ,振荡静置. ,振荡静置.
(3) 实验现象原来溴水显橙色,加入四氯化碳振荡后,液体分为两层,上层液体接近无色,下层液体为橙红色. |
|
由于溴  在四氯化碳中的溶解较大,而在水中的溶解度较小,且四氯化碳和水互不相溶,故能用四氯化碳将溴水中溴萃取出来,转移到下层的四氯化碳中.实验现象变化明显. 在四氯化碳中的溶解较大,而在水中的溶解度较小,且四氯化碳和水互不相溶,故能用四氯化碳将溴水中溴萃取出来,转移到下层的四氯化碳中.实验现象变化明显. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:058
在一支试管中加入2~3mL溴水,再向其中加入1mL四氯化碳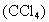 液体后振荡(四氯化碳的密度为
液体后振荡(四氯化碳的密度为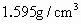 ,不溶于水)静置、溴水中的溴
,不溶于水)静置、溴水中的溴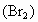 被提取到了四氯化碳中,请说明该操作的实验原理、实验步骤以及实验现象.
被提取到了四氯化碳中,请说明该操作的实验原理、实验步骤以及实验现象.
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)比较第3周期里的镁和铝的氢氧化物性质。
取两支试管,各注入1 mL硫酸镁(或氯化镁)溶液,各滴加1%的氢氧化钠溶液到有沉淀为止。在一支试管里加入1—2 mL盐酸,另一支试管里加入1—2 mL 1%的氢氧化钠溶液,观察氢氧化镁沉淀在两支试管中的溶解情况。请记录反应现象,并写出有关反应的化学方程式。
用硫酸铝代替硫酸镁溶液,做同样实验,结果怎样?写出有关反应的化学方程式。
(2)比较第3周期里非金属元素硫和氯的氢化物的稳定性。
取两支试管,在一支试管中加入2 mL氢硫酸,在另一支试管里加入2 mL盐酸,再向两支试管里各滴加溶有碘的碘化钾溶液(溶有碘的碘化钾溶液呈深红棕色,这是碘的颜色),观察两支试管中颜色变化,根据实验结果,作出哪种元素非金属性强的结论。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com