
| A. | 稀硫酸与氢氧化钡溶液反应:Ba2-+SO42-═BaSO4↓ | |
| B. | 氧化铜与稀硫酸混合:CuO+2H+═Cu2++H2O | |
| C. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+OH-═Cu(OH)2↓+SO42- | |
| D. | 氯化铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
分析 A.漏掉氢氧根离子与氢离子的反应;
B.氧化铜与稀硫酸混合,反应生成硫酸铜和水;
C.硫酸铜为可溶性盐,拆成离子;
D.氯化铝溶液中加入过量氨水,反应生成氢氧化铝.
解答 解:A.稀硫酸与氢氧化钡溶液反应,离子方程式:2H++2OH-+Ba2-+SO42-═BaSO4↓+2H2O,故A错误;
B.氧化铜与稀硫酸混合,离子方程式:CuO+2H+═Cu2++H2O,故B正确;
C.硫酸铜溶液与氢氧化钠溶液混合,离子方程式:Cu2++2OH-═Cu(OH)2↓,故C错误;
D.氯化铝溶液中加入过量氨水,离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选:B.
点评 本题考查了离子方程式的正误判断,熟悉离子方程式书写方法,明确反应实质是解题关键,注意离子反应须遵循客观事实.


科目:高中化学 来源: 题型:选择题
| A. | CuSO4溶液 | B. | NaOH溶液 | C. | Fe2O3 | D. | 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ | |
| C. | 反应4 min时,若HCl浓度为0.12 mol•L-1,则H2反应速率为0.03 mol•L-1•min-1 | |
| D. | 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol•L-1的NaOH溶液恰好反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的熔沸点逐渐降低 | B. | 卤素离子的还原性逐渐增强 | ||
| C. | 最高正化合价逐渐增大 | D. | 单质的氧化性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
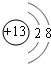 .
. .
.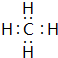 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水溶液的导电能力很弱 | |
| B. | 溶液中电离出的离子与未电离的分子共存 | |
| C. | 熔化时不导电 | |
| D. | 不是离子化合物而是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M<N<Y<X<Z | B. | N<M<X<Y<Z | C. | N<M<Y<X<Z | D. | X<Z<N<M<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
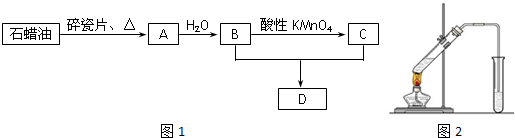
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com