
分析 五种短周期元素A、B、C、D、E的原子序数依次增大.A和B形成的共价化合物在水中呈碱性,该化合物为NH3,则A为氢元素、B为氮元素;A和C同族,C的原子序数大于氮元素,故C为Na元素;B和D 同族,则D为磷元素;C和E形成的化合物在水中呈中性,则E为Cl元素,验证符合,据此解答.
解答 解:五种短周期元素A、B、C、D、E的原子序数依次增大.A和B形成的共价化合物在水中呈碱性,该化合物为NH3,则A为氢元素、B为氮元素;A和C同族,C的原子序数大于氮元素,故C为Na元素;B和D 同族,则D为磷元素;C和E形成的化合物在水中呈中性,则E为Cl元素,
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故Na元素的原子半径最大;D为磷元素是第三周期第ⅤA族元素,故答案为:Na;第三周期第ⅤA族;
(2)上述元素的最高价氧化物对应的水化物酸性最强的是非金属性最强的氯对应的HClO4 ;非金属气态氢化物热稳定性最差的是非金属性最弱的磷,形成的磷化氢,故答案为:HClO4;PH3;
(3)这几种元素只有Na能与H形成离子化合物,则a的化学式为NaH电子式为:Na+[:H]-;A和E形成的化合物该化合物为HCl,与A和B形成的化合物该化合物为NH3反应,产物的化学式为氯化铵,化学式为:NH4Cl,既含离子键又含共价键,故答案为:Na+[:H]-;NH4Cl;离子键和共价键;
(4)钠先和水反应为氧化还原反应,氧化剂H2O,被氧化的元素Na,氧化产物NaOH,生成NaOH和氢气,反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,离子反应为2Na+2H2O═2Na++2OH-+H2↑,NaOH与硫酸铜发生复分解反应,反应的化学方程式为CuSO4+2NaOH═Cu(OH)2↓+Na2SO4,生成氢氧化铜和硫酸钠,离子反应为Cu2++2OH-=Cu(OH)2↓,总反应为:2Na+Cu2++2H2O=2Na++Cu(OH)2↓+H2↑,
故答案为:2Na+Cu2++2H2O=2Na++Cu(OH)2↓+H2↑;
(5)电解质熔融氯化钠生成钠和氯气,化学方程式:2NaCl$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑,故答案为:2NaCl$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑.
点评 本题考查位置结构性质关系、常用化学用语、元素周期律、化学键等,难度中等,推断元素是解题的关键,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
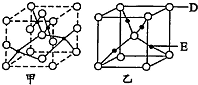 A、B、C、D、E五种元素的原子序数依次增大.A的原子序数等于周期数;B的最外层电子数是次外层电子数2倍,D的L层有两对成对电子;E+的核外有三个电子层,且都处于全满状态.试回答下列同题.
A、B、C、D、E五种元素的原子序数依次增大.A的原子序数等于周期数;B的最外层电子数是次外层电子数2倍,D的L层有两对成对电子;E+的核外有三个电子层,且都处于全满状态.试回答下列同题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏实验时向蒸馏烧瓶中放入几粒沸石(或碎瓷片) | |
| B. | 金属钠着火时使用泡沫灭火器灭火 | |
| C. | 用试管加热碳酸氢钠固体时使试管口略向上倾斜 | |
| D. | 浓硫酸溅到皮肤上立即用稀氢氧化钠溶液冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
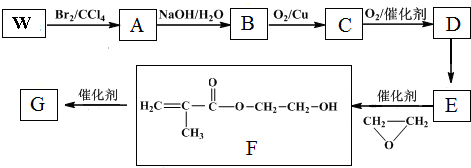
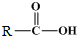 +
+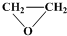 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$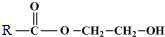
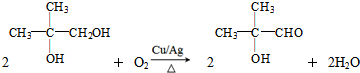 .
.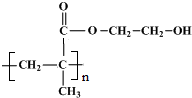 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使石蕊溶液呈红色的溶液中:Na+、SO42-、Fe3+、MnO4-可以大量共存 | |
| B. | NA代表阿伏加德罗常数的数值,1 mol硫酸氢钾晶体中阳离子所带电荷总数为NA | |
| C. | 235U与238U的相互转化不是化学变化 | |
| D. | 元素O、S、P的气态氢化物热稳定性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
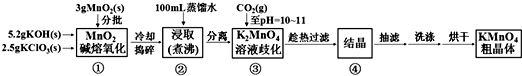
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com