
��10�֣�Na2SO3������ʵ�����г��ڱ����ױ��ʡ�
��1��ʵ������������Na2SO3������Ʒ�Ƿ��Ѿ����ʣ���ķ���Ϊ ��
��2��ѡ������װ�ú�ҩƷ��ͨ���ⶨ����SO2���������ɼ���m1 gNa2SO3������Ʒ�Ĵ��ȡ�
��Ӧԭ����H2SO4��Ũ��+Na2SO3 Na2SO4+SO2��+H2O
Na2SO4+SO2��+H2O
��ѡ�õ�ҩƷ����Ũ���� ��Ũ���� �ۼ�ʯ�� �ܵ���
��ѡ�õ�װ�����£�ͬһװ�ÿ��ظ�ѡ�ã�������ѡ����������˳������������������±��������������ж�Ӧ���ӵ��Լ���������Aװ���е�ҩƷ��������Ҫ��д���ɲ���������

|
ʵ��װ�ã�����ĸ�� |
D |
|
|
C |
|
|
|
|
װ������ʢҩƷ(�����) |
�� |
|
|
|
|
|
|
��3��ʵ������������Aװ������������m2 g��Bװ��������m3 g���ϱ�����֪��Cװ��������m4 g�����Na2SO3������Ʒ�Ĵ���Ϊ ��
��10�֣�
��1��ȡ������Ʒ�ܽ⣬�ȼ�����BaCl2��Һ���ټ�����ϡ����(���ȼ�����ϡ����,�ټ�����BaCl2��Һ)�������а�ɫ�������ڣ� ֤ ��Na2SO3���ʣ����ް�ɫ����֤��Na2SO3δ���ʡ�
��2������ǰ����ijһ�������˲�֮ǰ��ȷ�����÷֣�����÷֣�
|
ʵ��װ�ã�����ĸ�� |
|
A |
B |
|
C |
|
|
װ������ʢҩƷ(�����) |
|
|
�� |
�� |
�� |
|
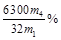 �������������𰸣� ���ڣ�1����3����2�֣��ڣ�2��ÿ��1�֣�
�������������𰸣� ���ڣ�1����3����2�֣��ڣ�2��ÿ��1�֣�
����������


 ��������ܸ�ϰϵ�д�
��������ܸ�ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
��13�֣�I��ijУ��ѧʵ��С��̽��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬���ⶨ(NH4)2S2O8��KI��Ӧ�Ļ�ѧ��Ӧ���ʡ���������ʵ��̽����
��ʵ��ԭ����
(NH4)2S2O8��KI��Ӧ�����ӷ���ʽΪ��S2O82�� + 2I��= 2SO42�� + I2 ��1��
ƽ����Ӧ���ʵļ���ʽΪv(S2O82��)= ��
ʵ��ʱ����KI��Na2S2O3�͵���ָʾ�������Һ�м���(NH4)2S2O8��Һ�����Ͻ��衣
�ڷ�Ӧ��1�����е�ͬʱ��������Ӧ��2S2O32��+ I2 = S4O62��+ 2I�� ��2��
��Ӧ(1)���ɵ�I2������S2O32����Ӧ��������ɫ��S4O62����I����S2O32���ľ�ʱ����Ӧ��1���������ɵ�I2����������ó�����ɫ���Ӽ���(NH4)2S2O8��Һ��������ɫ��ʱ��Ϊ��t��
��ʵ�����ݡ�
��1��ʵ��С����Ƶ�ʵ���¼�������ݼ�¼���£��뽫������ĸ��ʾ�Ŀո����ϡ�
| ʵ �� �� �� | �� | �� | �� | �� | �� | |
|
�Լ� ���� (mL) | 0.20 mol��L-1 (NH4)2S2O8��Һ | 20.0 | 10.0 | b | 20.0 | 20.0 |
| 0.20 mol��L-1 KI��Һ | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010 mol��L-1 Na2S2O3��Һ | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2% ������Һ | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20 mol��L-1KNO3��Һ | 0 | 0 | 0 | 10.0 | c | |
| 0.20 mol��L-1(NH4)2SO4��Һ | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20 ��ʱ����Ӧʱ�䦤t��s�� | 32 | 67 | 130 | 66 | 135 | |
| Ϊ��ʹ��Һ������ǿ�Ⱥ���������ֲ��䣬���ٵ�(NH4)2S2O8��Һ��KI��Һ���������ֱ���(NH4)2SO4��Һ��KNO3��Һ���㣻��Һ��Ϻ�������� |
��2��Ϊ��ʹ��Ӧ��ֽ��У�����������ʵ�������Ӧ�ò��Ͻ��еIJ����� ��
��3���ڢ���ʵ���v(S2O82��)= mol��(L��s)-1��
��4�������ϱ����ݷ��������Եõ��Ľ����У�д��һ�����ɣ�
��
II��ʵ��С������ϵ�֪������Na2CO3��Na2S��Һ��ͨ��SO2�������Ʊ�����ʵ�������Na2S2O3����Ӧ���£�Na2CO3+ SO2= Na2SO3 + CO2��2Na2S + 3SO2= 2Na2SO3 + 3S����
Na2SO3 + S= Na2S2O3����С���������ԭ�������ͼ��ʾװ���Ʊ�Na2S2O3��
��1��ʵ��Ӧ�����к������ŷŵ������С�װ�â١�����ʢ�ŵ��Լ�������
�� ��
�� ��
��2��ʵ������У����������ͨ�룬װ�â��������ݲ��������д�����ɫ��������������ͨ�����壬���Թ۲쵽�������� ��
��3����Ӧ�������Ƶõ�Na2S2O3ϡ��Һ�еõ�Na2S2O3��5H2O�������Ҫ���������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011������ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ�ʵ����
��13�֣�I��ijУ��ѧʵ��С��̽��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬���ⶨ(NH4)2S2O8��KI��Ӧ�Ļ�ѧ��Ӧ���ʡ���������ʵ��̽����
��ʵ��ԭ����
(NH4)2S2O8��KI��Ӧ�����ӷ���ʽΪ��S2O82�� + 2I��= 2SO42�� + I2 ��1��
ƽ����Ӧ���ʵļ���ʽΪv(S2O82��)=  ��
��
ʵ��ʱ����KI��Na2S2O3�͵���ָʾ�������Һ�м���(NH4)2S2O8��Һ�����Ͻ��衣
�ڷ�Ӧ��1�����е�ͬʱ��������Ӧ��2S2O32��+ I2 = S4O62��+ 2I�� ��2��
��Ӧ(1)���ɵ�I2������S2O32����Ӧ��������ɫ��S4O62����I����S2O32���ľ�ʱ����Ӧ��1���������ɵ�I2����������ó�����ɫ���Ӽ���(NH4)2S2O8��Һ��������ɫ��ʱ��Ϊ��t��
��ʵ�����ݡ�
��1��ʵ��С����Ƶ�ʵ���¼�������ݼ�¼���£��뽫������ĸ��ʾ�Ŀո����ϡ�
|
ʵ �� �� �� |
�� |
�� |
�� |
�� |
�� |
|
|
�Լ� ���� (mL) |
0.20 mol��L-1 (NH4)2S2O8��Һ |
20.0 |
10.0 |
b |
20.0 |
20.0 |
|
0.20 mol��L-1 KI��Һ |
20.0 |
20.0 |
20.0 |
10.0 |
5.0 |
|
|
0.010 mol��L-1 Na2S2O3��Һ |
a |
8.0 |
8.0 |
8.0 |
8.0 |
|
|
0.2% ������Һ |
2.0 |
2.0 |
2.0 |
2.0 |
2.0 |
|
|
0.20 mol��L-1KNO3��Һ |
0 |
0 |
0 |
10.0 |
c |
|
|
0.20 mol��L-1(NH4)2SO4��Һ |
0 |
10.0 |
15.0 |
0 |
0 |
|
|
20 ��ʱ����Ӧʱ�䦤t��s�� |
32 |
67 |
130 |
66 |
135 |
|
|
Ϊ��ʹ��Һ������ǿ�Ⱥ���������ֲ��䣬���ٵ�(NH4)2S2O8��Һ��KI��Һ���������ֱ���(NH4)2SO4��Һ��KNO3��Һ���㣻��Һ��Ϻ�������� |
��2��Ϊ��ʹ��Ӧ��ֽ��У�����������ʵ�������Ӧ�ò��Ͻ��еIJ����� ��
��3���ڢ���ʵ���v(S2O82��)= mol��(L��s)-1��
��4�������ϱ����ݷ��������Եõ��Ľ����У�д��һ�����ɣ�
��
II��ʵ��С������ϵ�֪������Na2CO3��Na2S��Һ��ͨ��SO2�������Ʊ�����ʵ�������Na2S2O3����Ӧ���£�Na2CO3 + SO2= Na2SO3 + CO2��2Na2S + 3SO2 = 2Na2SO3 + 3S����
Na2SO3 + S= Na2S2O3����С���������ԭ�������ͼ��ʾװ���Ʊ�Na2S2O3��

��1��ʵ��Ӧ�����к������ŷŵ������С�װ�â١�����ʢ�ŵ��Լ�������
�� ��
�� ��
��2��ʵ������У����������ͨ�룬װ�â��������ݲ��������д�����ɫ��������������ͨ�����壬���Թ۲쵽�������� ��
��3����Ӧ�������Ƶõ�Na2S2O3ϡ��Һ�еõ�Na2S2O3��5H2O�������Ҫ���������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ʡ�¿��� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
I��ijУ��ѧʵ��С��̽��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬���ⶨ(NH4)2S2O8��KI��Ӧ�Ļ�ѧ��Ӧ���ʡ���������ʵ��̽����
��ʵ��ԭ����
![]() (NH4)2S2O8��KI��Ӧ�����ӷ���ʽΪ��S2O82�� + 2I��= 2SO42�� + I2 ��1��
(NH4)2S2O8��KI��Ӧ�����ӷ���ʽΪ��S2O82�� + 2I��= 2SO42�� + I2 ��1��
ƽ����Ӧ���ʵļ���ʽΪv(S2O82��)= ��
ʵ��ʱ����KI��Na2S2O3�͵���ָʾ�������Һ�м���(NH4)2S2O8��Һ�����Ͻ��衣
�ڷ�Ӧ��1�����е�ͬʱ��������Ӧ��2S2O32��+ I2 = S4O62��+ 2I�� ��2��
��Ӧ(1)���ɵ�I2������S2O32����Ӧ��������ɫ��S4O62����I����S2O32���ľ�ʱ����Ӧ��1���������ɵ�I2����������ó�����ɫ���Ӽ���(NH4)2S2O8��Һ��������ɫ��ʱ��Ϊ��t��
��ʵ�����ݡ�
��1��ʵ��С����Ƶ�ʵ���¼�������ݼ�¼���£��뽫������ĸ��ʾ�Ŀո����ϡ�
| ʵ �� �� �� | �� | �� | �� | �� | �� | |
| �Լ� ���� (mL) | 0.20 mol��L-1 (NH4)2S2O8��Һ | 20.0 | 10.0 | b | 20.0 | 20.0 |
| 0.20 mol��L-1 KI��Һ | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010 mol��L-1 Na2S2O3��Һ | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2% ������Һ | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20 mol��L-1KNO3��Һ | 0 | 0 | 0 | 10.0 | c | |
| 0.20 mol��L-1(NH4)2SO4��Һ | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20 ��ʱ����Ӧʱ�䦤t��s�� | 32 | 67 | 130 | 66 | 135 | |
| Ϊ��ʹ��Һ������ǿ�Ⱥ���������ֲ��䣬���ٵ�(NH4)2S2O8��Һ��KI��Һ���������ֱ���(NH4)2SO4��Һ��KNO3��Һ���㣻��Һ��Ϻ�������� | ||||||
��2��Ϊ��ʹ��Ӧ��ֽ��У�����������ʵ�������Ӧ�ò��Ͻ��еIJ����� ��
��3���ڢ���ʵ���v(S2O82��)= mol��(L��s)-1��
��4�������ϱ����ݷ��������Եõ��Ľ����У�д��һ�����ɣ�
��
II��ʵ��С������ϵ�֪������Na2CO3��Na2S��Һ��ͨ��SO2�������Ʊ�����ʵ�������Na2S2O3����Ӧ���£�Na2CO3 + SO2= Na2SO3 + CO2��2Na2S + 3SO2 = 2Na2SO3 + 3S����
Na2SO3 + S= Na2S2O3����С���������ԭ�������ͼ��ʾװ���Ʊ�Na2S2O3��
|
|
|
|

��1��ʵ��Ӧ�����к������ŷŵ������С�װ�â١�����ʢ�ŵ��Լ�������
�� ��
�� ��
��2��ʵ������У����������ͨ�룬װ�â��������ݲ��������д�����ɫ��������������ͨ�����壬���Թ۲쵽�������� ��
��3����Ӧ�������Ƶõ�Na2S2O3ϡ��Һ�еõ�Na2S2O3��5H2O�������Ҫ���������� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com