
| A. | 相邻的原子之间的相互作用叫做化学键 | |
| B. | 金属和非金属元素的相互化合,都能形成离子键 | |
| C. | 钠元素的原子半径比其阳离子半径大 | |
| D. | 氯元素的原子半径比其阴离子半径小 |
分析 A.相邻的原子之间强烈的相互作用叫做化学键;
B.金属和非金属元素可以形成共价键;
C.阳离子的半径小于其原子半径;
D.阴离子的半径大于其原子半径.
解答 解:A.相邻的原子之间强烈的相互作用叫做化学键,原子之间的相互作用不一定是化学键,如He原子之间的作用力为分子间作用力,故A错误;
B.金属和非金属元素可以形成共价键,如Al与Cl元素结合形成的AlCl3中只含有共价键,故B错误;
C.阳离子的半径小于其原子半径,则钠元素的原子半径比其阳离子半径大,故C正确;
D.阴离子的半径大于其原子半径,则氯元素的原子半径比其阴离子半径小,故D正确.
故选CD.
点评 本题考查了化学键的概念、微粒半径大小比较,题目难度不大,注意把握化学键的概念以及微粒半径大小比较规律.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:解答题
 已知:Br2常温下呈液态,易挥发,有毒;如图为实验室模拟工业过程从浓缩的海水中提取溴的实验装置.其实验步骤如下:
已知:Br2常温下呈液态,易挥发,有毒;如图为实验室模拟工业过程从浓缩的海水中提取溴的实验装置.其实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;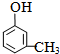 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 15:13 | C. | 7:8 | D. | 8:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| 物质 选 项 | a | b | c |
| A | Si | SiO2 | H2SiO3 |
| B | H2SO4 | SO2 | SO3 |
| C | Al | AlCl3 | Al(OH)3 |
| D | NaCl | Na | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH4、C2H4燃烧生成水的质量相同,消耗氧气不同 | |
| B. | C2H4燃烧生成水与CO2的物质的量相等 | |
| C. | CH4含氢量最高,燃烧生成水最多 | |
| D. | C2H2含碳量最高,燃烧生成的CO2最多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com