
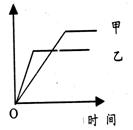
 C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼ״̬��Ϊc��A����0��100 mol��L��1��c��B����0��200mol��L��1��c��C����0 mol��L��1. �����������£���Ӧ��A��Ũ����ʱ��ı仯����ͼ��ʾ��
C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼ״̬��Ϊc��A����0��100 mol��L��1��c��B����0��200mol��L��1��c��C����0 mol��L��1. �����������£���Ӧ��A��Ũ����ʱ��ı仯����ͼ��ʾ��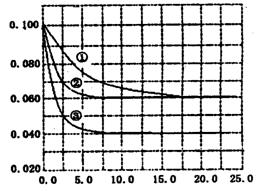
 C�ġ�H>0
C�ġ�H>0
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 xC(g) ��H = QKJ/mol
xC(g) ��H = QKJ/mol xc(g)�ﵽƽ�⣬��ʱ��üס�����������C�����������Ϊ0.2 ��
xc(g)�ﵽƽ�⣬��ʱ��üס�����������C�����������Ϊ0.2 ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO(g) + H2O(g) ����ƽ�ⳣ���˺��¶�t�Ĺ�ϵ���£�
CO(g) + H2O(g) ����ƽ�ⳣ���˺��¶�t�Ĺ�ϵ���£�| t�� | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
 CO(g) + H2O(g)���ڸ������ڸ����ʵ�Ũ�ȱ仯���£�
CO(g) + H2O(g)���ڸ������ڸ����ʵ�Ũ�ȱ仯���£�| ʱ��/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2O ( mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
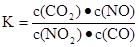 ����ʱ�������¶ȣ�����������ɫ�������˵����ȷ����
����ʱ�������¶ȣ�����������ɫ�������˵����ȷ����| A���÷�Ӧ�Ļ�ѧ����ʽΪ��NO2��CO===CO2��NO |
| B���÷�Ӧ���ʱ�Ϊ��ֵ |
| C�������¶ȣ�����Ӧ���ʼ�С |
| D������ʱ������ѹǿ����ɫ�����ƽ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ��2����ĩ��Ӧ�ﵽƽ��״̬��������0.8mol D������д����հף�
��2����ĩ��Ӧ�ﵽƽ��״̬��������0.8mol D������д����հף��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| | ��Ӧ | ������ | �� | �� |
| A | �������ء��Ʒֱ���ˮ��Ӧ | H 2���� | �� | �� |
| B | ��ͬ����������ͬһ������ 2NH3 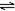 N2+3H2 N2+3H2 | ������ת���� | 500�� | 400�� |
| C | �����1:3��N2��H2��������ɱ�ĺ�ѹ�����У�2NH3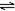 N2+3H2 N2+3H2 | ������Ũ�� | ���ԸߵĴ��� | ����һ��Ĵ��� |
| D | 2 mol S02��l mol 02������ͬ�¶���2S02+02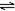 2S03 2S03 | S03���ʵ��� | 10atm | 2atm |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 NO2 ��H>0��Ӧ�У�������30���100��ʱƽ����ϵ��NO�İٷֺ����뷴Ӧ��ϵ��ѹǿp�Ĺ�ϵ����ͼ�е�
NO2 ��H>0��Ӧ�У�������30���100��ʱƽ����ϵ��NO�İٷֺ����뷴Ӧ��ϵ��ѹǿp�Ĺ�ϵ����ͼ�е�
|
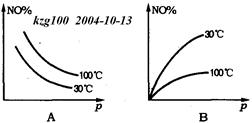
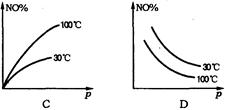
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
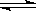 C(g)+2D(g)�ﵽƽ��������¶�������������ܶ���������������һ����ȷ����
C(g)+2D(g)�ﵽƽ��������¶�������������ܶ���������������һ����ȷ����| A������Ӧ�����ȷ�Ӧ����A������̬ |
| B������Ӧ�Ƿ��ȷ�Ӧ����A����̬ |
| C����������C������A��ת�������� |
| D���ı�ѹǿ�Ը�ƽ����ƶ���Ӱ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
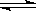 2SO3(g) ��H<0����Ӧ�ֱ������������У��ﵽƽ���c(SO2)��С����
2SO3(g) ��H<0����Ӧ�ֱ������������У��ﵽƽ���c(SO2)��С����| A��500�棬10molSO2 +5molO2 | B��500�棬20molSO2 +5molO2 |
| C��400�棬10molSO2 +5molO2 | D��400�棬15molSO3�ֽ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com