
| A. | 21:5 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
分析 测定ClO-与Cl-的浓度之比为1:6,设物质的量分别为1mol、6mol,设生成NaClO3为x,结合电子守恒计算.
解答 解:Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液,
Cl元素的化合价由0升高为+1、+5价,Cl元素的化合价由0降低为-1价,
测定ClO-与Cl-的浓度之比为1:6,设物质的量分别为1mol、6mol,设生成NaClO3为x,
由电子守恒可知,6mol×(1-0)=1mol×(1-0)+x×(5-0),解得x=1mol,
反应时被还原的氯与被氧化的氯的物质的量之比为6mol:(1mol+1mol)=3:1,
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化、电子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ①④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol/L的NaHSO4溶液中,含阳离子总数为0.2NA | |
| B. | 由2gH2、88gCO2、36gH2O组成的混合气体,密度约是相同状况下O2密度的0.79倍 | |
| C. | 1molAl与足量Na0H溶液反应生成H2的体积为33.6L | |
| D. | 56gFe单质与足量S单质在加热条件下充分反应,转移电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 6.2 g Na2O所含的离子数为0.2 NA | |
| B. | 46 gNO2与N2O4的混合气体中所含的原子数是3NA | |
| C. | 2.8 gN2中含有共用电子对的数目为0.1 NA | |
| D. | 0.1 molH2与Cl2的混合气体充分反应后,体系中含有共价键总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
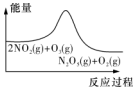 |  |  |  |
| 平衡后升温,NO2含量降低 | 0~2s内,v(O2)=0.2mol•L-1•s-1 | v正:b点>a点,b点:v逆>v正 | 恒温,t1时再充入O3 |
| A. | .A. | B. | .B | C. | .C | D. | .D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物 氢氧化钙 Ca(OH)2 | B. | 酸性氧化物 二氧化碳 CO2 | ||
| C. | 酸 硫酸 H2S | D. | 盐 烧碱 Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
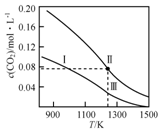 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)=2P总(状态Ⅰ) | |
| C. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强酸pH=a,加水稀释到10n倍,则pH=a+n | |
| B. | 弱酸pH=a,加水稀释到10n倍,则pH<a+n(a+n<7) | |
| C. | 强碱pH=b,加水稀释到10n倍,则pH=b-n | |
| D. | 弱碱pH=b,加水稀释到10n倍,则pH=b-n(b-n>7) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com