
| A、饱和Ca(OH)2溶液中加入一定量的生石灰,恢复至原来的温度,得溶液的pH值会增大 |
| B、等体积、等pH的NH4Cl溶液和盐酸,完全溶解少量且等同的镁粉,前者反应快 |
| C、将nmol H2(g)、n mol I2(g)和2n mol H2(g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 |
| D、某物质的溶液中由水电离出的c(H+)=1×10-amol.L-1,若α>7时,则该溶液的pH一定为14-α |


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
| A、新能源具有可再生和无污染等特点,所以应大力提倡采用太阳能、风能和生物质能 |
| B、加高工厂的烟囱,使烟尘和废气远离地表,可减少环境污染 |
| C、可利用分光光度计,通过比色法测定化学反应速率 |
| D、在海伦外壳镶入锌块,可减缓船体的腐蚀速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,Ph=12的NaOH溶液中含有OH-的数目为0.01NA |
| B、1L 0.25mol.L-1醋酸溶液中含CH3COOH分子数为0.25NA |
| C、7.8gNa2O2中阴阳离子总数为0.4NA |
| D、标准状况下,2.24L氧气与氮气的混合气体所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2的水解产物是NaOH和H2O2 |
| B、PCl3的水解产物是PH3和HClO |
| C、Mg3N2的水解产物是Mg(OH)2和NH3 |
| D、SiCl4的水解产物是H4SiO4与HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属元素的原子最外层电子数越少,则该元素的金属性越强 |
| B、同周期元素原子半径和离子半径从左到右均依次减小 |
| C、第三周期非金属氧化物对应水化物的酸性从左到右依次增强 |
| D、第ⅦA族元素气态氢化物的还原性从上到下依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸和食醋既是化合物又是酸 |
| B、含氧酸酸性越强与铁片反应放出氢气的速率越快 |
| C、含4%硅的硅钢具有很好的导磁性,主要用作变压器铁芯 |
| D、蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硝基苯的结构简式: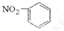 | ||
B、NH4Cl的电子式: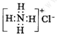 | ||
C、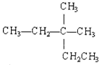 的名称为:3,3二甲基戍烷 的名称为:3,3二甲基戍烷 | ||
D、具有16个质子、16个种子和18个电子的微粒一定是
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
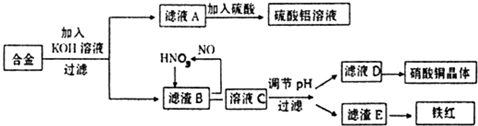
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com