
【题目】磷酸铝(AlPO4)是一种用途广泛的材料,在建筑、耐火材料、化工等方面具有广泛的应用前景。以磷硅渣(主要成分为Ca3(PO4)2、Al2O3、SiO2和V2O5等)为原料制备磷酸铝的工艺流程如图所示:

回答下列问题:
(1)酸浸液中含磷元素的主要粒子是_____(填化学式,下同),浸渣中的主要化学成分是_____。
(2)生石灰除了调节pH外,另一作用是_____。
(3)滤液中钒元素以V3O93-形式存在,V3O93-易水解为[VO3(OH)]2-,该水解反应的离子方程式为_____。
(4)碱浸时,粗磷酸铝转化为可溶性溶质,则可溶性溶质分别是_____ (填化学式)。
(5)实验测得pH、反应温度与时间对碱浸时固相中P、Al含量的影响如图所示:

则最优反应条件是_____。
(6)固相反应制备磷酸铝的方法之一是在900℃的焙烧炉内加热磷酸二氢铵与氧化铝混合物,写出该反应的化学方程式:_____。
【答案】H3PO4 SiO2、CaSO4 除去过量的SO42- V3O93-+3H2O3[VO3(OH)]2-+3H+ Na[Al(OH)4]、Na3PO4 pH=12、温度为80℃、时间为1h Al2O3+2NH4H2PO4![]() 2AlPO4+2NH3↑+3H2O
2AlPO4+2NH3↑+3H2O
【解析】
磷硅渣的主要成分为Ca3(PO4)2、Al2O3、SiO2和V2O5等,加浓硫酸分离出滤渣为SiO2、CaSO4,酸浸液中加CaO可调节pH且除去过量硫酸根离子,滤渣1为CaSO4,滤液中钒元素以V3O93-形式存在,加NaOH分离出Na2[VO3(OH)],再加NaOH时粗磷酸铝溶解生成可溶性溶质为NaAlO2、Na3PO4,由图可知,pH=12、温度为80℃、时间为1h时碱浸时固相中P、Al含量w%小,为最优反应条件,然后过滤分离出AlPO4;
(1)SiO2为酸性氧化物,不与硫酸反应;CaSO4微溶于水,据此回答;
(2)加浓硫酸引人过量的硫酸根离子,CaSO4微溶于水,据此回答;
(3)滤液中钒元素以V3O93-形式存在,V3O93-易水解为[VO3(OH)]2;
(4)加NaOH时粗磷酸铝溶解生成可溶性溶质为NaAlO2、Na3PO4;
(5)在pH、反应温度与时间对碱浸时固相中P、Al含量的影响如图中,寻找碱浸时固相中P、Al 含量w%小时就为最优反应条件;
(6)加热磷酸二氢铵与氧化铝混合物生成AlPO4、NH3和H2O。
(1)酸浸中磷元素主要转化为H3PO4,该反应的化学方程式为Ca3(PO4)2+3H2SO4=3CaSO4+2H3PO4,磷硅渣的主要成分为Ca3(PO4)2、Al2O3、SiO2和V2O5等,加浓硫酸分离出滤渣为SiO2、CaSO4;
(2)生石灰除了调节pH 外,另一作用是除去过量的硫酸根离子;
(3)滤液中钒元素以V3O93-形式存在,V3O93-易水解为[VO3(OH)]2,该水解反应的离子方程式为V3O93-+3H2O3[VO3(OH)]2-+3H+;
(4)碱浸时,粗磷酸铝转化为可溶性溶质,则可溶性溶质分别是Na[Al(OH)4]、Na3PO4;
(5)由图可知,pH=12、温度为80℃、时间为1h时碱浸时固相中P、Al 含量w%小,为最优反应条件;
(6)加热磷酸二氢铵与氧化铝混合物生成AlPO4、NH3和H2O,化学方程式为:Al2O3+2NH4H2PO4![]() 2AlPO4+2NH3↑+3H2O.
2AlPO4+2NH3↑+3H2O.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。
Ⅰ.经查:①Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10;②Ka(HNO2)=5.1×10-4。请设计最简单的方法鉴别NaNO2和NaCl两种固体______________________
Ⅱ. 某小组同学用如下装置(略去夹持仪器)制备亚硝酸钠
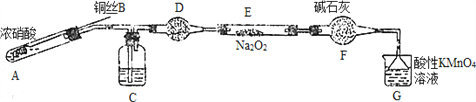
已知:①2NO+Na2O2=2NaNO2; ②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+。
(1)使用铜丝的优点是________________________。
(2)装置A中发生反应的化学方程式为_____________________________。
装置C中盛放的药品是_________;(填字母代号)
A.浓硫酸 B.NaOH溶液 C.水 D.四氯化碳
(3)该小组称取5.000g制取的样品溶于水配成250ml溶液,取25.00ml溶液于锥形瓶中,
用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③该样品中亚硝酸钠的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物M是一种药品辅料的中间体,下图是该有机化合物的合成线路。请回答下列问题。
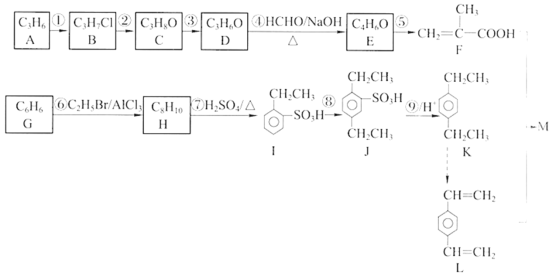
已知: i.
ii.两种或两种以上的单体发生的加聚反应称为共聚反应,如:

(1)A的结构简式是_________。
(2)反应②的化学方程式是_________。
(3)合成线路①~⑤中属于氧化反应的有_________(填序号)。
(4)反应④的化学方程式是_________。
(5)若1mol D与2mol HCHO反应,该反应产物的结构简式是_________。
(6)反应⑧的反应物及反应条件是_________。
(7)合成线路中⑦~⑨的目的是_________。
(8)在一定条件下,F与L按物质的量之比1 : 1发生共聚反应合成M,其链节中不含碳碳双键,且除苯环外不含其他环状结构,则M的结构简式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制出一种能在室温下高效催化空气中的甲醛氧化的催化剂,其反应如下:HCHO+O2 ![]() CO2+H2O。下列有关说法正确的是( )
CO2+H2O。下列有关说法正确的是( )
A.反应物和生成物都是非极性分子
B.HCHO 的空间构型为四面体形
C.HCHO、CO2 分子的中心原子的杂化类型不同
D.液态水中只存在一种作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
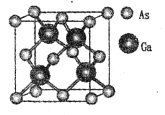
【题目】
GaN是制造5G芯片的材料,氮化镓和氮化铝LED可发出紫外光。回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]____。
(2)根据元素周期律,元素的电负性Ga____ (填“大于”或“小于”,下同)As。
(3)科学家合成了一种阳离子为“N5n+”,其结构是对称的,5个N排成“V”形,每个N原子都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N5n+”化学式为“N8”的离子晶体,其电子式为____,其中的阴离子的空间构型为____。
(4)组成相似的CaF3和GaCl3晶体,前者属于离子晶体,后者属于分子晶体。从F-和Cl-结构的不同分析其原因是________。
(5)原子晶体GaAs的晶胞参数a=xpm,它的晶胞结构如下图所示。该晶胞内部存在的共价键数为 ___;紧邻的As原子之间的距离为b,紧邻的As、Ca原子之间的距离为d,则b:d=____,该晶胞的密度为__g cm-3。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
①二氧化硅可与NaOH溶液反应,因此可用NaOH溶液雕刻玻璃;
② 明矾溶于水可水解生成Al(OH)3胶体,因此可以用明矾对自来水进行杀菌消毒;
③ 可用蒸馏法、电渗析法、离子交换法等对海水进行淡化;
④ 从海带中提取碘只需用到蒸馏水、H2O2溶液和四氯化碳三种试剂;
⑤地沟油可用来制肥皂、提取甘油或者生产生物柴油;
⑥石英玻璃、Na2O·CaO·6SiO2、淀粉、氨水的物质类别依次为纯净物、氧化物、混合物、弱电解质。
A. ③⑤⑥ B. ①④⑤ C. 除②外都正确 D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四硼酸钠的阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示。下列说法不正确的是( )
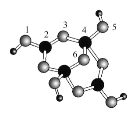
A.阴离子中三种元素的第一电离能:O>B>H
B.在Xm-中,硼原子轨道的杂化类型有sp2和sp3
C.配位键存在于4、5原子之间和4、6原子之间
D.m=2,NamX的化学式为Na2B4O5(OH)4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g) ![]() 2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡时,其他条件不变,升高温度可提高 SO2 的转化率
B.其他条件不变,缩小容器体积,平衡正反应方向移动,该反应的平衡常数不变
C.平衡前,充入氩气,容器内压强增大,反应速率加快
D.平衡时,其他条件不变,分离出硫,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷催化裂解、氧气部分氧化和水煤气重整是目前制氢的常用方法。回答下列问题:
(1)甲烷隔绝空气分解,部分反应如下:
Ⅰ.CH4(g)=C(s)+2H2(g) H1=+74.9kJ/mol
Ⅱ.6CH4(g)=C6H6(g)+9H2(g) H2=+531kJ/mol
Ⅲ.2CH4(g)=C2H4(g)+2H2(g) H3=+202kJ/mol
①反应I的△S___(填“>”或“<”)0。
②![]() 的 △H=______kJ/mol。
的 △H=______kJ/mol。
(2)CH4用水蒸气重整制氢包含的反应为:
Ⅰ.水蒸气重整:![]()
Ⅱ.水煤气变换:![]()
平衡时各物质的物质的量分数如图所示:
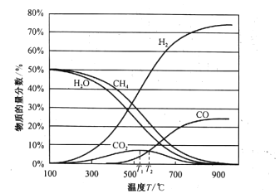
①为提高CH4的平衡转化率,除压强、温度外,还可采取的措施是___________(写一条)。
②温度高于T1℃时,CO2的物质的量分数开始减小,其原因是___________。
③T2℃时,容器中![]() ______________。
______________。
(3)甲烷部分氧化反应为![]() 。已知甲烷部分氧化、甲烷水蒸气重整、水煤气变换反应的平衡常数的自然对数lnKp与温度的关系如图所示:
。已知甲烷部分氧化、甲烷水蒸气重整、水煤气变换反应的平衡常数的自然对数lnKp与温度的关系如图所示:
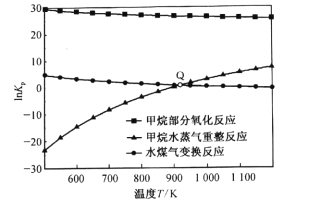
①图中Q点时,反应![]() 的InKp=________。
的InKp=________。
②在某恒压密闭容器中充入lmol CH4和1mol H2O(g)在某温度下发生水蒸气重整反应达到平衡时,CH4的转化率为50%,容器总压强为1 atm。H2的平衡分压p(H2)=____atm;此温度下反应的lnKp=___(已知;ln3≈l.1,ln4≈l.4)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com