
实验得出,无水氯化铝在常压条件下不同温度时的密度为
| t(℃) | 200 | 400 | 600 | 800 |
| ρ(g/L) | 6.881 | 4.236 | 2.650 | 1.517 |
| 气体摩尔体积(L/mol) | 38.8 | 55.2 | 71.6 | 88.0 |
可见,400℃时无水氯化铝存在形式的化学式为
A.AlCl3 B.Al2Cl6 C.AlCl3和Al2Cl6 D.Al3Cl9和Al2Cl6
科目:高中化学 来源: 题型:
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)
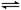 2NH3(g),一种工业合成氨,进而合成尿素的的简易流程图如下:
2NH3(g),一种工业合成氨,进而合成尿素的的简易流程图如下:
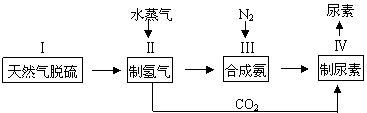 |
(1)步骤II中制氢气原理如下:
CH4(g)+H2O(g)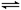 CO(g)+3H2(g) CO(g)+H2O(g)
CO(g)+3H2(g) CO(g)+H2O(g)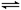 CO2(g)+H2(g)
CO2(g)+H2(g)
恒容容器中,对于以上反应,能加快反应速率的是 。
a. 升高温度 b. 充入He c. 加入催化剂 d. 降低压强
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为
。
(3)CO2和H2在高温、高压、催化剂条件下可合成CH3CH2OH,反应的化学方程式
_________________________________。以CH3CH2OH、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:_________________________。
(4)已知尿素的结构简式为H2N-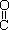 -NH2,请写出尿素的同分异构体中含有离子键的化学式 。
-NH2,请写出尿素的同分异构体中含有离子键的化学式 。
(5)已知CO2+ 2NH3  CO(NH2)2 + H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成 吨尿素。
CO(NH2)2 + H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成 吨尿素。
查看答案和解析>>
科目:高中化学 来源: 题型:
比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射氯乙烷(沸点12.27℃)进行局部冷冻麻醉应急处理。乙烯和氯化氢在一定条件下制得氯乙烷的化学反应方程式是(有机物用结构简式表示) ,该反应类型是 ,该反应的原子利用率为 ,决定氯乙烷能用于冷冻麻醉应急处理的具体性质是
查看答案和解析>>
科目:高中化学 来源: 题型:
通过复习总结,你认为下列对化学知识概括合理的是
A.能跟酸反应的氧化物,都是碱性氧化物
B.凡具有正四面体结构的分子中,其键角均为109°28′
C.有新单质生成的化学反应一定都是氧化-还原反应
D.核外电子总数相同的原子,一定是同种元素的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于砷(As)元素的叙述中,正确的是
A.第一电离能:As<Se,电负性As<Se
B.在AsCl3分子中,砷和氯原子核外电子数均为8
C.砷酸的酸性比亚砷酸强,且砷酸钠溶液呈碱性
D.AsH3的VSEPR模型为三角锥形,其中As原子采取sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次增大的A、B、C、D、E、F、G七种前四周期元素(稀有气体除外),常温下,有三种元素对应的单质呈气态,C与D同族。其中A原子核外有六种不同运动状态的电子,C为地壳中含量做多的元素,F的简单离子是同周期主族元素形成的简单离子中氧化性最弱的,G的基态原子的最外能层只有一个电子,其他能层均已充满电子。
(1)电负性越大的原子,对键合电子的吸引能力越强,通常对应元素化合价呈现负价。根据B、C、D、E四种元素形成的常见化合物的化合价,确定电负性最大的元素,写出其基态原子的电子排布图 。
(2)甲是由B元素等非金属元素组成的离子化合物,甲可由E的氢化物溶液与电解质乙溶液反应生成,写出该反应的离子方程式 。
(3)A元素可形成多种单质,一种晶体结构如图一所示,该晶体与熔融的F单质相互作用,形成某种青铜色的物质(其中的元素F用“●”表示),原子分布如图二所示,该物质的化学式为 。另一种的晶胞如图三所示,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为___________g·cm-3(保留两位有效数字)。
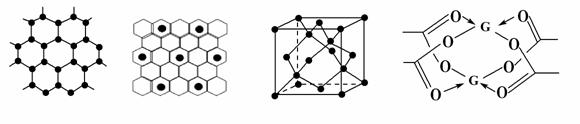 图一 图二 图三 图四
图一 图二 图三 图四
(4)G元素形成的单质,其晶体的堆积模型为________,G的醋酸盐晶体局部结构如图四,该晶体中含有的化学键是________(填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
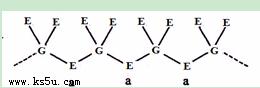
(5)E和F与不同价态的G可组成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均是由G和E两元素形成的无限长链结构(如下图),已知其中一种化合物的化学式为FGE3,另一种的化学式为 。
(6)若物质F2D3是一种含有非极性共价键的离子化合物,各原子最外层都满足8e-稳定结构,请你写出该化合物阴离子的电子式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是人类资源的宝库,“海水晒盐”是获取食盐的重要来源。食盐既是一种生活必需品,也是一种重要的工业原料。以食盐为原料可以得到多种产品。工业上主要通过电解饱和氯化钠溶液的方法获得氢氧化钠。
(1)阳极反应式为 ,检验该电极反应产物的方法是: 。
(2)当阴极和阳极上共收集到气体22.4 L时(标准状况下,假设产生的气体完全被收集),则电路中通过电子的个数为 。
(3)电解氯化钠稀溶液可以制备“84”消毒液,若通电时产生的氯气被溶液完全吸收,且最终所得消毒液仅含一种溶质,请写出相应的化学方程式:
(用一个方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.1 mol·L-1NaCl溶液含有NA个Na+
B.10 mL质量分数为98%的H2SO4用水稀释至100 mL,H2SO4的质量分数应大于9.8%
C.配制240 mL 1 mol·L-1的NaOH溶液需称NaOH固体的质量为9.6 g
D.配制1 mol·L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com