
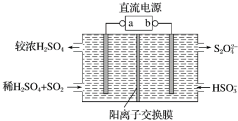
 利用图中所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2.下列说法正确的是( )
利用图中所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2.下列说法正确的是( )| A. | a为直流电源的负极 | |
| B. | 一段时间后,阴极区溶液的pH减小 | |
| C. | 阳极的电极反应式为SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 电解时,H+由阴极室通过阳离子交换膜到阳极室 |
分析 依据图示可知,二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,阳极区发生反应SO2-2e-+2H2O═SO42-+4H+,阳极与电源的正极a相连,b为电源负极,阴极的电极反应式为:2HSO3-+2H++2e-═S2O42-+2H2O,阳离子交换膜只允许阳离子通过,电解时,阳离子移向阴极,据此分析.
解答 解:A、二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,阳极与电源正极a相连,故A错误;
B、阴极的电极反应式为:2HSO3-+2H++2e-═S2O42-+2H2O,所以一段时间后,阴极区溶液的pH增大,故B错误;
C、阳极的电极反应式为:SO2+2H2O-2e-═SO42-+4H+,故C正确;
D、阳离子交换膜只允许阳离子通过,电解时,阳离子移向阴极,所以H+由阳极室通过阳离子交换膜到阴极室,故D错误;
故选C.
点评 本题考查了电解原理的分析应用,主要是电极反应,电极名称判断,理解电解池原理是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 ,该化合物属于离子化合物(填“共价”或“离子”).
,该化合物属于离子化合物(填“共价”或“离子”). ,该化合物含的化学键类型是共价键.
,该化合物含的化学键类型是共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内A、B、C的浓度之比为1:2:2 | |
| B. | 单位时间消耗0.2 mol/L B同时生成0.2 mol/L C | |
| C. | 容器内压强不随时间变化 | |
| D. | 容器内B的浓度不随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
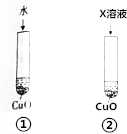 氧化铜可溶于稀硫酸,某同学为探究稀硫酸中的哪种粒子(H2O、H+、SO42-)使氧化铜溶解设计了如下实验.
氧化铜可溶于稀硫酸,某同学为探究稀硫酸中的哪种粒子(H2O、H+、SO42-)使氧化铜溶解设计了如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 由 CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1366.8 kJ•mol-1,可知乙醇的标准燃烧热为1366.8 kJ•mol-1 | |
| B. | 已知:C(金刚石,s)=C(石墨,s)△H<0,则金刚石比石墨稳定 | |
| C. | 已知:N2(g)+O2(g)═2NO(g)△H=+180 kJ•mol-1 2CO(g)+O2(g)═2CO2 (g)△H=-566 kJ•mol-1 则 2CO(g)+2NO(g)═N2 (g)+2CO2(g)△H=-746 kJ•mol-1 | |
| D. | OH-(aq)+H+(aq)═H2O(l)△H=-57.3 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com