
| 实验 | 现象 | 离子方程式 |
| 1.将少量氯水分别加入盛有NaBr溶液(试管①)和KI溶液(试管②)中,用力振荡后加入少量四氯化碳,振荡,静置 | 写出试管②中的实验现象 溶液分层下层为紫红色 | 写出试管①中的离子方程式: Cl2+2Br-=2Cl-+Br2 |
| 2.将少量溴水加入盛有KI溶液(试管③)中,用力振荡后加入少量四氯化碳,振荡,静置 | 现象略 | 写出试管③中的离子方程式: Br2+2I-=2Br-+I2 |
| 实验结论: 元素非金属性由强到弱的顺序为:Cl>Br>I. | ||
分析 元素的非金属性越强,其单质的氧化性越强,同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性;氯气能氧化溴离子生成溴单质,能氧化碘离子生成碘单质,溴能氧化碘离子生成碘单质,据此判断非金属性强弱.
解答 解:将少量氯水滴入KI溶液中,用力振荡后加入少量四氯化碳,振荡,静置,发现KI溶液分层,且下层溶液呈紫色,说明氯气将碘离子氧化生成碘单质;
将少量氯水滴入NaBr溶液中,用力振荡后加入少量四氯化碳,振荡,静置,发现NaBr溶液分层,且下层溶液呈橙色,说明氯气将溴离子氧化生成溴单质,离子反应方程式为Cl2+2Br-=2 Cl-+Br2;
将少量溴水加入盛有KI溶液(试管③)中,用力振荡后加入少量四氯化碳,振荡,静置,溶液分层且下层为紫红色,说明溴将碘离子氧化生成碘单质,离子方程式为Br2+2I-=2 Br-+I2,
①中氧化剂是Cl2、氧化产物是Br2,②中氧化剂是Cl2、氧化产物的I2,③中氧化剂是Br2、氧化产物是I2,
所以氧化性强弱顺序是Cl2>Br2>I2,元素的非金属性越强,其单质的氧化性越强,所以非金属性强弱顺序是Cl>Br>I,
故答案为:
| 实验 | 现象 | 离子方程式 |
| 溶液分层下层为紫红色 | Cl2+2Br-=2 Cl-+Br2 | |
| Br2+2I-=2 Br-+I2 | ||
| Cl>Br>I | ||
点评 本题以卤素单质之间的置换反应为载体考查同一主族元素性质递变规律,明确非金属性强弱与其单质氧化性强弱关系是解本题关键,易错点是化学用语正确运用,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
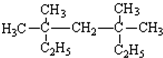 系统命名为:3,3,5,5-四甲基庚烷.
系统命名为:3,3,5,5-四甲基庚烷.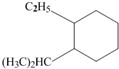 的炔烃的结构简式:
的炔烃的结构简式: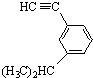 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
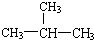
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
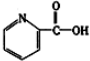 ②阿斯匹林
②阿斯匹林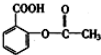
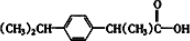 ④东茛菪内酯
④东茛菪内酯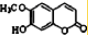
| A. | ①④ | B. | ②④ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核外电子排布相同的微粒,其化学性质也相同 | |
| B. | 含有金属元素和非金属元素的化合物不一定是离子化合物 | |
| C. | 仅含非金属元素的化合物一定是共价化合物 | |
| D. | 凡需要加热的反应一定是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com