
| A. | 8和11 | B. | 6和8 | C. | 12和9 | D. | 11和17 |
分析 活泼金属和活泼金属元素之间易形成离子键,铵盐中含有离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,据此分析解答.
解答 解:A.8、11号元素分别是O、Na元素,二者可以通过得失电子形成离子键,故A不选;
B.6、8号元素分别是C、O元素,二者可以通过共用电子对形成共价键,故B选;
C.12、9号元素分别是Mg、F元素,二者可以通过得失电子形成离子键,故C不选;
D.11、17号元素分别是Na、Cl元素,二者可以通过得失电子形成离子键,故D不选;
故选B.
点评 本题考查元素周期表及离子键形成,为高频考点,侧重考查学生分析判断能力,明确离子键和共价键区别是解本题关键,注意不能根据是否含有金属元素判断离子键,如氯化铝是共价化合物,铵盐都是离子化合物.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应的反应限度都相同 | |
| B. | 当一个化学反应在一定条件下达到限度时,正逆反应速率相等 | |
| C. | 可以通过延长化学反应的时间改变化学反应的限度 | |
| D. | 当一个化学反应在一定条件下达到限度时,反应即停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:As>C1>P | B. | 热稳定性:HC1>AsH3>HBr | ||
| C. | 还原性:AsH3>H2S>HC1 | D. | 酸性:H3AsO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
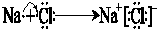 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 金属及其化合物在人类生活、生产中发挥着重要的作用.
金属及其化合物在人类生活、生产中发挥着重要的作用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com