
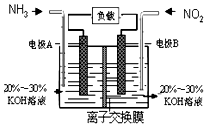
 空气质量与我们的健康息息相关,目我国通过检测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2、和CO是其中3项中的污染物.
空气质量与我们的健康息息相关,目我国通过检测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2、和CO是其中3项中的污染物.分析 (1)从空气污染的角度分析,利用酸雨形成的过程相关知识解决;
(2)反应的平衡常数表达式为生成物的浓度幂之积比上反应物浓度幂之积;
(3)根据方程式知,6NO2+8NH3═7N2+12H2O中NO2中N元素化合价由+4价变为0价、NH3中N元素化合价由-3价变为0价,所以NO2发生还原反应、NH3发生氧化反应,则A是负极、B是正极,负极电极方程式为2NH3-6e-+6OH-=N2+6H2O,正极反应式为2NO2+8e-+4H2O=8OH-+N2,由此分析解答.
解答 解:(1)SO2、NO2和CO中,能和空气中的水蒸气反应的有SO2、NO2,SO2+H2O=H2SO3 H2SO3进一步被氧气氧化为硫酸,3NO2+H2O=2HNO3+NO,硫酸和硝酸融入雨水,形成酸雨,在空气中CO不能与水反应,故答案为:SO2、NO2;
(2)反应的平衡常数表达式为生成物的浓度幂之积比上反应物浓度幂之积,所以ClO2-+2SO32-?2SO42-+Cl-,平衡常数为:K=$\frac{c(C{l}^{-}){c}^{2}(S{O}_{4}^{2-})}{c(Cl{O}_{2}^{-}){c}^{2}(S{O}_{3}^{2-})}$,
故答案为:K=$\frac{c(C{l}^{-}){c}^{2}(S{O}_{4}^{2-})}{c(Cl{O}_{2}^{-}){c}^{2}(S{O}_{3}^{2-})}$;
(3)根据方程式知,6NO2+8NH3═7N2+12H2O中NO2中N元素化合价由+4价变为0价、NH3中N元素化合价由-3价变为0价,所以NO2发生还原反应、NH3发氧化反应,则A是负极、B是正极,负极电极方程式为2NH3-6e-+6OH-=N2+6H2O,所以电极A极反应式为2NH3-6e-+6OH-═N2+6H2O,当有4.48 L NO2 被处理时,参加反应的NO2物质的量为0.2mol,转移电子物质的量=0.2mol×[4-0]=0.8mol,
故答案为:2NH3+6e-+6OH-=N2+6H2O; 0.8NA.
点评 本题考查化学电源新型电池,为高频考点,明确化学反应中化合价升降与正负极的关系是解本题关键,难点是电极反应式的书写,注意电子流向判断,题目难度不大.


科目:高中化学 来源: 题型:实验题
 某学生用0.4000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.4000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+ | |
| B. | 含等物质的量的FeBr2、Fel2的溶液中,缓慢通入氯气:I-、Fe2+、Br- | |
| C. | 含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:Ba(OH)2、KOH、BaCO3、K2CO3 | |
| D. | 含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:OH-、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ca2+ | |
| B. | 某溶液与NaOH溶液共热,产生使湿润红色石蕊试纸变蓝气体,说明原溶液中存在NH4+ | |
| C. | 某溶液加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,则一定含有CO32- | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2和N2O4浓度相等 | B. | NO2和N2O4分子数之比为2:1 | ||
| C. | 体系颜色不再发生变化 | D. | N2O4不再分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | Ba(OH)2 | C. | AgNO3 | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
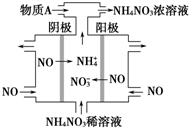 2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有:
2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4=Na2++SO42- | B. | MgCl2=Mg2++Cl- | ||
| C. | HNO3=H++3NO- | D. | Ba(OH)2=Ba2++2OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com