
| A. | ①②③⑥ | B. | ②③④⑥ | C. | ③④⑤⑥ | D. | ⑤⑥ |
分析 ①电子的运动速度极快;
②电子的质量约为质子质量的$\frac{1}{1836}$,电子质量很小且带负电荷
③电子在原子核周围很小的空间里运动,但相对电子而言该运动区域是“广阔的”
④运动速度接近光速;
⑤电子没有固定的运动轨道;
⑥电子的运动速度极快,运动速度接近光速.
解答 解:①电子的运动速度极快,所以不能测定某一时刻电子所处的位置,故①错误;
②电子的质量约为质子质量的$\frac{1}{1836}$,质量为9.3×10-31Kg,所以电子的质量很小,电子带一个单位的负电荷,故②正确;
③电子在原子核周围很小的空间里运动,但相对电子而言该运动区域是“广阔的”,故③正确;
④电子运动速度接近光速,故④正确;
⑤电子运动速度快,运动空间小,没有固定的运动轨道,故⑤错误;
⑥电子的运动速度极快,运动速度接近光速,现代最先进的扫描隧道显微镜也观察不到电子的运动,故⑥正确;
故选B.
点评 本题考查核外电子运动有关知识,题目基础性强,贴近教材,有利于对基础知识的巩固.


科目:高中化学 来源: 题型:解答题
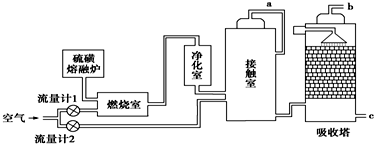
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Y、N的最高价氧化物中,Y、N与氧原子之间均为双键 | |
| B. | 一定条件下,Y单质能置换出N单质,M能置换出X单质 | |
| C. | N元素位于元素周期表中第3周期I V族 | |
| D. | 四种元素的原子半径:X<Y<M<N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 2:3 | D. | 5:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
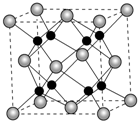 A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(OH)CH3 | B. | CH3CH2CH2CH2OH | C. | CH3CH2CH2OH | D. | CH3CH2OCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以确定该微粒为Ne | |
| B. | 对应元素的单质可能是强还原剂 | |
| C. | 对应元素可能是电负性最大的元素 | |
| D. | 对应元素可能位于元素周期表中第13列 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 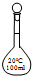 100mL容量瓶 100mL容量瓶 | B. |  100mL集气瓶 | C. | 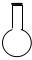 100mL烧瓶 | D. |  100mL滴瓶 100mL滴瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com